题目内容
为提高氯化铵的经济价值,我国化学家设计了利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁(MgOHCl)的工艺.某同学根据该原理设计的实验装置如图:
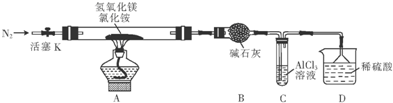
请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为 .
装置B中碱石灰的作用是 .
(2)反应过程中持续通入N2的作用有两点:一是使反应产生的氨气完全导出并被稀硫酸充分吸收,二是 .
(3)装置C的试管中反应的离子方程式为 .

请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为
装置B中碱石灰的作用是
(2)反应过程中持续通入N2的作用有两点:一是使反应产生的氨气完全导出并被稀硫酸充分吸收,二是
(3)装置C的试管中反应的离子方程式为
考点:制备实验方案的设计
专题:实验设计题
分析:在加热条件下氢氧化镁和氯化铵反应生成碱式氯化镁、氨气,通入氮气,可使氨气全部被氯化铝溶液吸收,并防止倒吸,以此解答该题.
解答:
解:(1)根据题意:利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁(MgOHCl),发生的反应为:Mg(OH)2+NH4Cl
MgOHCl+NH3↑+H2O,碱石灰可以用来干燥氨气,
故答案为:Mg(OH)2+NH4Cl
MgOHCl+NH3↑+H2O;干燥氨气;
(2)由于氨气是极易溶于水的,反应过程中持续通入N2,可以使反应产生的氨气完全导出并被稀硫酸充分吸收,并还能防止装置C中的氯化铝溶液倒吸入装置B,
故答案为:防止装置C中的AlCl3溶液倒吸入装置B;
(3)氨水和氯化铝反应生成氯化铵和氢氧化铝,反应的离子方程式为Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+.
| ||
故答案为:Mg(OH)2+NH4Cl
| ||
(2)由于氨气是极易溶于水的,反应过程中持续通入N2,可以使反应产生的氨气完全导出并被稀硫酸充分吸收,并还能防止装置C中的氯化铝溶液倒吸入装置B,
故答案为:防止装置C中的AlCl3溶液倒吸入装置B;
(3)氨水和氯化铝反应生成氯化铵和氢氧化铝,反应的离子方程式为Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+.
点评:本题考查物质的制备,侧重于学的分析能力和实验能力的考查,注意把握物质的性质的应用和判断,要求学生具有较强的分析和解决问题的能力,难度中等.

练习册系列答案
相关题目
化学与人类生活、社会可持续发展密切相关,下列措施有利于节能减排、保护环境的是( )
①加快化石燃料的开采与使用;
②研发易降解的生物农药;
③应用高效洁净的能源转换技术;
④田间焚烧秸秆;
⑤酶催化反应具有高效、专一、条件温和等特点,化学模拟生物酶对绿色化学、环境保护及节能减排具有重要意义.
①加快化石燃料的开采与使用;
②研发易降解的生物农药;
③应用高效洁净的能源转换技术;
④田间焚烧秸秆;
⑤酶催化反应具有高效、专一、条件温和等特点,化学模拟生物酶对绿色化学、环境保护及节能减排具有重要意义.
| A、①③⑤ | B、②③⑤ |
| C、①②④ | D、②④⑤ |
下列各组物质的分类正确的是( )
①混合物:氯水、氨水、水玻璃、水银、福尔马林、聚乙烯
②电解质:明矾、冰醋酸、石膏、纯碱
③共价化合物:CO2、CC14、CH3CH3、NH4NO3
④同位素:1 H+、2H2、3H
⑤同素异形体:C60、C80、金刚石、石墨
⑥同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2
⑦同分异构体:乙二酸二乙酯、乙二酸乙二酯.
①混合物:氯水、氨水、水玻璃、水银、福尔马林、聚乙烯
②电解质:明矾、冰醋酸、石膏、纯碱
③共价化合物:CO2、CC14、CH3CH3、NH4NO3
④同位素:1 H+、2H2、3H
⑤同素异形体:C60、C80、金刚石、石墨
⑥同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2
⑦同分异构体:乙二酸二乙酯、乙二酸乙二酯.
| A、②⑤ | B、②④⑤⑦ |
| C、②⑤⑥⑦ | D、全部正确 |
 利用下列装置可以完成的实验组合是( )
利用下列装置可以完成的实验组合是( )