题目内容
11.如图是一种新型锂电池原理图,下列有关叙述正确的是( )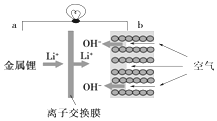
| A. | a为电源正极 | B. | 电流从a流向b | ||
| C. | 离子交换膜为阳离子交换膜 | D. | b电极处,O2失电子生成OH- |
分析 原电池中Li失电子生成锂离子,Li为负极,b极上氧气得电子生成氢氧根离子,b为正极,结合离子的移动方向分析.
解答 解:A.原电池中Li失电子生成锂离子,Li为负极,即a为负极,故A错误;
B.原电池中电流从正极流向负极,即电流从b流向a,故B错误;
C.由图可知,锂离子透过交换膜向正极移动,所以离子交换膜为阳离子交换膜,故C正确;
D.b电极处,O2得电子生成OH-,故D错误.
故选C.
点评 本题考查化学电源新型电池,题目难度不大,注意根据电池反应书写电极反应式的方法以及两个电极上发生的反应,明确离子的定向移动问题是解题的关键.

练习册系列答案
相关题目
1.在含有c(NH4Cl)=3c(AlCl3)的溶液中滴加一定量的稀NaOH溶液,则下列离子方程式不符合实际反应情况的是( )
| A. | Al3++3NH4++6OH-=Al(OH)3↓+3NH3•H2O | |
| B. | 2Al3++NH4++7OH-=2Al(OH)3↓+NH3•H2O | |
| C. | Al3++3NH4++7OH-=AlO2-+3NH3•H2O+2H2O | |
| D. | Al3++5NH4++9OH-=AlO2-+5NH3•H2O+2H2O |
2.下列实验操作或仪器的使用图示中正确的是( )
| A. | 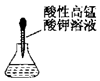 滴加药品的使用 | B. | 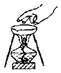 移走加热的蒸发皿 | ||
| C. | 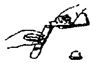 液体药品的取用 | D. | 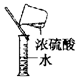 稀释浓硫酸 |
6. I.用NH3催化还原NxOy可以消除氮氧化物的污染.
I.用NH3催化还原NxOy可以消除氮氧化物的污染.
已知:反应①:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
反应②:2NO(g)+O2(g)?2NO2(g)△H2 (且|△H1|=2|△H2|)
反应③:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H3
反应①和反应②在不同温度时的平衡常数及其大小关系如表
(1)推测反应③是吸热反应(填“吸热”或“放热”)
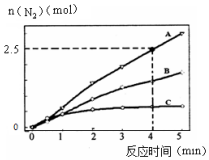
(2)相同条件下,反应①在2L密闭容器内,选用不同催化剂,反应产生N2的量随时间变化如图所示.
①计算0~4分钟在A催化剂作用下,反应速率v(NO)=0.375mol•L-1•min-1.
②下列说法正确的是CD.
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当温度不变时,说明反应已经达到平衡.
 I.用NH3催化还原NxOy可以消除氮氧化物的污染.
I.用NH3催化还原NxOy可以消除氮氧化物的污染.已知:反应①:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
反应②:2NO(g)+O2(g)?2NO2(g)△H2 (且|△H1|=2|△H2|)
反应③:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H3
反应①和反应②在不同温度时的平衡常数及其大小关系如表
| 温度/K | 反应① | 反应② | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
(2)相同条件下,反应①在2L密闭容器内,选用不同催化剂,反应产生N2的量随时间变化如图所示.
①计算0~4分钟在A催化剂作用下,反应速率v(NO)=0.375mol•L-1•min-1.
②下列说法正确的是CD.
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当温度不变时,说明反应已经达到平衡.