题目内容
3. 利用I2O5可消除CO污染或定量测定CO,反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s);△H 1
利用I2O5可消除CO污染或定量测定CO,反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s);△H 1(1)已知:2CO(g)+O2(g)?2CO2(g);△H 2
2I2(s)+5O2(g)?2I2O5(s);△H 3
则△H 1=2.5△H2-0.5△H3(用含△H 2和△H 3的代数式表示).
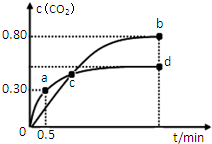
(2)不同温度下,向装有足量I2O5固体的1L恒容密闭容器中通入1molCO,测得CO2的浓度c(CO2)随时间t变化曲线如图.请回答:
①从反应开始至a点时的反应速率为v(CO)=0.6 mol•L-1•min-1,b点时化学平衡常数Kb=1024.
②d点时,温度不变,若将容器体积压缩至原来的一半,请在图中补充画出CO2体积分数的变化曲线.
③下列说法正确的是AB.(填字母序号)
A.容器内气体密度不变,表明反应达到平衡状态
B.两种温度下,c点时体系中混合气体的平均相对分子质量相等
C.增加I2O5的投料量有利于提高CO的转化率
D.b点和d点的化学平衡常数:Kb<Kd.
分析 (1)根据盖斯定律和已知反应可得;
(2)①起始量和a点时CO2的体积分数(即物质量分数),列式计算即可求出从反应开始至a点时的反应速率为v(CO);根据b点时CO2的体积分数φ(CO2求出平衡浓度[CO]和[CO2]进而求出b点时化学平衡常数Kb;
②对于反应前后气体的物质的量不变的反应,加压平衡不移动;
③A.因为条件为恒容,而反应前后气体质量变化,所以容器内气体密度是变量,当不变时表明反应达到平衡状态;
B.c点为交点,各气体物质的量分别相等;
C.I2O5为固体,所以增加投料量对平衡无影响;
D.b点比d点时生成物CO2体积分数大,说明进行的程度大,则化学平衡常数:Kb>Kd;
解答 解:(1)根据盖斯定律和已知反应:2CO(g)+O2(g)?2CO2(g)△H 2-----②
2I2(s)+5O2(g)?2I2O5(s)△H 3-----③
可知反应:5CO(g)+I2O5(s)?5CO2(g)+I2(s)可由①×2.5-②×0.5得到;则△H 1=2.5△H2-0.5△H3,
故答案为:2.5△H2-0.5△H3;
(2)①a点时:5CO(g)+I2O5(s)?5CO2(g)+I2(s)
起始量/mol 2 0
转化量/mol x x
a点量/mol 2-x x
根据a点时CO2的体积分数φ(CO2)=$\frac{x}{2}$=0.30,得x=0.6mol
则从反应开始至a点时的反应速率为v(CO)=$\frac{0.6mol}{2L×0.5mol}$=0.6mol•L-1•min-1,
b点时:5CO(g)+I2O5(s)?5CO2(g)+I2(s)
起始量/mol 2 0
转化量/mol y y
b点量/mol 2-y y
根据b点时CO2的体积分数φ(CO2)=$\frac{y}{2}$=0.80,得y=1.6mol,[CO]=0.2mol•L-1,[CO2]=0.8mol•L-1
b点时化学平衡常数Kb=$\frac{[C{O}_{2}]^{5}}{[CO]^{5}}$=1024,
故答案为:0.6mol•L-1•min-1;1024;
②d点时,温度不变,若将容器体积压缩至原来的一半,即加压,但由于反应前后气体的物质的量不变,所以平衡不移动,CO2体积分数不变,
故答案为: ;
;
③A.因为条件为恒容,而反应前后气体质量变化,所以容器内气体密度不变时,表明反应达到平衡状态,故A正确;
B.c点为交点,气体物质的量分别相等,所以两种温度下,体系中混合气体的平均相对分子质量相等,故B正确;
C.I2O5为固体,所以增加投料量对平衡无影响,CO的转化率不变,故C错误;
D.b点比d点时生成物CO2体积分数大,说明进行的程度大,则化学平衡常数:Kb>Kd,故D错误;
故答案为:AB.
点评 本题考查了根据盖斯定律求焓变、反应速率和化学平衡常数计算、氧化还原反应等知识,综合性较强,注意图象变化和绘制方法,题目难度中等.


| A. | 4 min时反应第一次达到平衡 | |
| B. | 15 min时降低压强,20 min时升高温度 | |
| C. | 反应方程式中的x=1,正反应为吸热反应 | |
| D. | 15~20 min该反应使用了催化剂 |
| A. | 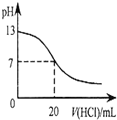 表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 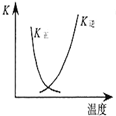 图中曲线表示反应2SO2(g)+O2(g)═2SO3(g)△H<0 正、逆反应的平衡常数K随温度的变化 | |
| C. | 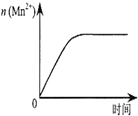 表示10 mL 0.01 mol•L-1 KMnO4酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化 | |
| D. |  图中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 |
| A. | Fe | B. | Al | C. | Cu | D. | Si |
| A. | 蒸馏 | B. | 萃取 | C. | 分液 | D. | 蒸发结晶 |
| A. | 将NA个NH3分子气体溶于1L水中得到1mol•L-1的氨水 | |
| B. | 标况下,22.4L三氧化硫中含有NA个分子 | |
| C. | 1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA个电子 | |
| D. | 各5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA |