题目内容
 氯化银胶体中的分散质粒子实际上是一个个由很多“AgCl”结合而成的集合体.向盛有NaCl溶液的试管中滴加AgNO3溶液,静置后用一束光照射试管,发现试管的三个不同区域中只有一个区域具有明显的丁达尔效应,则下列分析正确的是( )
氯化银胶体中的分散质粒子实际上是一个个由很多“AgCl”结合而成的集合体.向盛有NaCl溶液的试管中滴加AgNO3溶液,静置后用一束光照射试管,发现试管的三个不同区域中只有一个区域具有明显的丁达尔效应,则下列分析正确的是( )| A、该区域是A,该区域中AgCl的直径最小 |
| B、该区域是B,该区域中AgCl的直径介于A、C区域之间 |
| C、该区域是C,该区域中AgCl的直径最大 |
| D、各区域AgCl的大小都相同,但只有B区域中分散质的大小介于1~100 nm之间 |
考点:胶体的重要性质,分散系、胶体与溶液的概念及关系
专题:
分析:AgCl属于难溶物,静置后A、B、C三个区域中,A区域应为溶液,C区域为沉淀,只有B区域属于胶体.
解答:
解:AgCl属于难溶物,静置后A、B、C三个区域中,A区域应为溶液,C区域为沉淀,只有B区域属于胶体.胶体中分散质粒子(即题中所述“集合体”)的大小介于1~100nm之间,单个的AgCl直径都相等.
故选D.
故选D.
点评:本题考查胶体的重要性质,难度不大,注意胶体中分散质粒子(即题中所述“集合体”)的大小介于1~100nm之间,单个的AgCl直径都相等.

练习册系列答案
相关题目
已知:2H2O2=O2↑+2H2O,下列各组实验中,反应速率最快的是( )
| 实验序号 | H2O2溶液浓度/% | H2O2溶液体积/mL | 温度/℃ | MnO2用量/g |
| A | 5 | 10 | 20 | 0.1 |
| B | 15 | 10 | 20 | 0.1 |
| C | 20 | 10 | 30 | 0 |
| D | 20 | 10 | 30 | 0.1 |
| A、A | B、B | C、C | D、D |
与下列反应对应的离子方程式书写正确的是( )
| A、铁跟稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| B、碳酸钙溶于醋酸:CaCO3+2H+=Ca2++H2O+CO2↑ |
| C、Na2CO3溶液的水解:CO32-+2H2O?H2CO3+2OH- |
| D、碳酸镁跟硫酸反应:MgCO3+2H+=Mg2++H2O+CO2↑ |
下列各图中,表示正反应是吸热反应的图是( )
A、 |
B、 |
C、 |
D、 |
绿矾(FeSO4?7H2O)的相关性质如下图所示,反应①至⑥均在隔绝空气条件下进行,气体1、2、3的摩尔质量依次增大.

下列推断合理的是( )

下列推断合理的是( )
| A、能发生氧化还原反应的只有①、②、④、⑥ |
| B、将反应①和反应③产生的气体混合,气体颜色发生变化 |
| C、反应⑤生成的固体在空气中高温灼烧只发生分解反应 |
| D、将气体1和气体3冷凝再混合,能计算出所得溶液的物质的量浓度 |
设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、1 mol AlCl3在熔融状态时离子总数为0.4NA |
| B、标准状况下,2.24L苯中含有的C-H键的数目为0.6NA |
| C、2.2g分子式为 2H218O的水中含有的中子数为1.2 NA |
| D、电解饱和食盐水时,当阴极产生H2 22.4L时,电路中转移的电子数为2NA |
设阿伏加德罗常数为NA,则下列说法正确的是( )
| A、11.2LNH3中含有的氢原子数为1.5NA |
| B、0.2mol/L的NaAlO2溶液含有0.2NA个Al3+ |
| C、常温常压下,18g水的原子数为3NA |
| D、32gO2与O3的混合物含有分子数为NA |
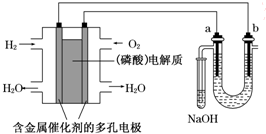 用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极).下列说法中,正确的是( )
用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极).下列说法中,正确的是( )| A、电池工作时,正极反应式为:O2+2H2O+4e-═4OH- |
| B、电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其他条件相同时前者的还原性强于后者 |
| C、电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 |
| D、忽略能量损耗,当电池中消耗0.2 g H2时,b极周围会产生2.24L H2 |
环境问题已成为制约社会发展和进步的严重问题.下列做法或说法不正确的是( )
| A、PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,也称细颗粒物,这些细颗粒物分散在空气中形成的分散系是胶体 |
| B、将煤气化或液化,获得清洁燃料 |
| C、大力发展新能源汽车,如混合动力汽车、电动汽车等,以减少碳、氮氧化物的排放 |
| D、绿色化学的核心是利用化学原理从头上减少和消除工农业生产等对环境的污染 |