题目内容
取Pt和Zn为电极材料埋入人体内作为心脏起搏器的能源,它跟人体的体液中含有一定浓度的溶解O2、H+和Zn2+进行作用.
(1)其正极的反应式为 .
(2)该电池在0.8V、40μW条件下进行工作,则工作电流为 A.
(3)将5g锌埋入人体内,则可维持 年才需要第二次手术进行更换(取二位有效数字)?
(1)其正极的反应式为
(2)该电池在0.8V、40μW条件下进行工作,则工作电流为
(3)将5g锌埋入人体内,则可维持
考点:化学电源新型电池
专题:电化学专题
分析:(1)Pt、Zn和电解质溶液构成原电池,Zn易失电子发生氧化反应而作负极、Pt作正极,正极上氧气得电子发生还原反应;
(2)功率=UI,则I=
;
(3)n(Zn)=
=
mol,锌完全反应失去电子的物质的量=
mol×2=
mol,1mol电子是6.02×1023个电子,每个电子带的电荷量是1.6×10-19C,1mol电子带的电荷量是:6.02×1023×1.6×10-19C=96320C,则
mol电子的电量=14818.45C,电流I=5.0×10-5A,则时间s=
.
(2)功率=UI,则I=
| 功率 |
| U |
(3)n(Zn)=
| 5g |
| 65g/mol |
| 1 |
| 13 |
| 1 |
| 13 |
| 2 |
| 13 |
| 2 |
| 13 |
| Q |
| I |
解答:
解:(1)Pt、Zn和电解质溶液构成原电池,Zn易失电子发生氧化反应而作负极、Pt作正极,正极上氧气得电子发生还原反应,电解质溶液呈酸性,所以氧气得电子和氢离子反应生成水,电极反应式为O2+4H++4e-=2H2O,故答案为:O2+4H++4e-=2H2O;
(2)功率=UI,则I=
=
=5.0×10-5A,
故答案为:5.0×10-5;
(3)n(Zn)=
=
mol,锌完全反应失去电子的物质的量=
mol×2=
mol,1mol电子是6.02×1023个电子,每个电子带的电荷量是1.6×10-19C,1mol电子带的电荷量是:6.02×1023×1.6×10-19C=96320C,则
mol电子的电量=14818.45C,电流I=5.0×10-5A,则时间s=
=
=2.96×108s=9.386年,根据实际需要,应该为9.3年,
故答案为:9.3.
(2)功率=UI,则I=
| 功率 |
| U |
| 40×10-6A |
| 0.8V |
故答案为:5.0×10-5;
(3)n(Zn)=
| 5g |
| 65g/mol |
| 1 |
| 13 |
| 1 |
| 13 |
| 2 |
| 13 |
| 2 |
| 13 |
| Q |
| I |
| 14818.46C |
| 5.0×10-5A |
故答案为:9.3.
点评:本题考查物理、化学知识,属于学科间综合题,明确各个物理量之间的关系式即可解答,会结合电解质溶液酸碱性书写电极反应式,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
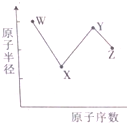 短周期元素W、X、Y和Z的原子半径随原子序数的变化如图所示.在周期表中,W和X的族序数之和等于Z的族序数.其中X的单质是空气的成分之一,元素Y是地壳中含量最丰富的金属元素,元素Z的原子最外层电子数是其电子层数的2倍.下列叙述不正确的是( )
短周期元素W、X、Y和Z的原子半径随原子序数的变化如图所示.在周期表中,W和X的族序数之和等于Z的族序数.其中X的单质是空气的成分之一,元素Y是地壳中含量最丰富的金属元素,元素Z的原子最外层电子数是其电子层数的2倍.下列叙述不正确的是( )| A、W的简单离子半径小于氢元素的简单阴离子的半径 |
| B、Y与Z形成的化合物可以通过溶液中复分解获取 |
| C、运输Z的最高价氧化物对应水化物的浓溶液可用Y单质材料容器 |
| D、X的简单氢化物的沸点比Z的简单氢化物的沸点高 |
将下列固体溶于水,再讲其溶液加热蒸发,结晶后再灼烧,得到的固体与原固体物质相同的是( )
①硫酸铝 ②胆矾 ③FeCl3 ④小苏打 ⑤碳酸铵 ⑥次氯酸钠 ⑦硫酸亚铁.
①硫酸铝 ②胆矾 ③FeCl3 ④小苏打 ⑤碳酸铵 ⑥次氯酸钠 ⑦硫酸亚铁.
| A、①②④⑦ | B、②⑥ |
| C、③⑤ | D、只有① |
已知乙炔的燃烧热是1230kJ/mol,H2的燃烧热是285.8kJ/mol,现有11.2L(标准状况下)乙炔(C2H2)和氢气的混合气体,完全燃烧能放出457.6kJ热量,则混合气体中乙炔和氢气的物质的量之比是( )
| A、1:1 | B、2:1 |
| C、1:2 | D、2:3 |
对下列化学用语的理解和描述均正确的是( )
A、电子式  可以表示羟基.也可以表示氢氧根离子 可以表示羟基.也可以表示氢氧根离子 |
B、比例模型 可以表示二氧化碳分子,也可以表示水分子 可以表示二氧化碳分子,也可以表示水分子 |
C、原子结构示意图 可以表示12C,也可以表示14C 可以表示12C,也可以表示14C |
D、结构示意图为 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 |



 电解池、原电池对于金属冶炼、实验室研究具有十分重要的意义.
电解池、原电池对于金属冶炼、实验室研究具有十分重要的意义. (R、R表示烃基)则该原电池的负极反应式为
(R、R表示烃基)则该原电池的负极反应式为