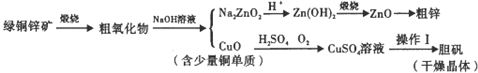
题目内容
10.硫有多种含氧酸,亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸(H2SO4?SO3)、硫代硫酸(H2S2O3)等等,其中硫酸最为重要,在工业上有广泛的应用.在实验室,浓硫酸是常用的干燥剂.完成下列计算:
(1)焦硫酸(H2SO4.SO3)溶于水,其中的SO3都转化为硫酸.若将445g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为1.25mol/L.
(2)若以浓硫酸吸水后生成H2SO4.H2O计算,250g质量分数为98%的硫酸能吸收多少g水?
(3)硫铁矿是工业上制硫酸的主要原料.硫铁矿氧化焙烧的化学反应如下:
3FeS2+8O2→Fe3O4+6SO2 4FeS2+11O2→2Fe2O3+8SO2
若48molFeS2完全反应耗用氧气2934.4L(标准状况),计算反应产物中Fe3O4与Fe2O3物质的量之比.
(4)用硫化氢制取硫酸,既能充分利用资源又能保护环境,是一种很有发展前途的制备硫酸的方法.
硫化氢体积分数为0.84的混合气体(H2S、H2O、N2)在空气中完全燃烧,若空气过量77%,计算产物气体中SO2体积分数(水是气体).
已知空气组成:N2体积分数0.79、O2体积分数0.21.
分析 (1)n(H2SO4.SO3)=$\frac{445g}{178g/mol}$=2.5mol,每个焦硫酸分子可以吸水后成为2个硫酸分子,所以C=$\frac{n({H}_{2}S{O}_{4}.S{O}_{3})×2}{V}$;
(2)根据浓硫酸吸水后生成H2SO4•H2O计算,硫酸与水的物质的是为1:1;
(3)设Fe3O4与Fe2O3物质的量分别为amol,bmol然后铁守恒和消耗氧气的量列方程组解;
(4)根据2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O,设混合所体为1体积,则硫化氢为0.84体积,然后关系式来求解.
解答 解:(1)n(H2SO4.SO3)=$\frac{445g}{178g/mol}$=2.5mol,每个焦硫酸分子可以吸水后成为2个硫酸分子,所以C=$\frac{n({H}_{2}S{O}_{4}.S{O}_{3})×2}{V}$=$\frac{2.5mol×2}{4L}$=1.25mol/L,
故答案为:1.25;
(2)n(H2SO4•H2O)=n(H2SO4)=$\frac{250g×98%}{98g/mol}$=2.5mol,所以吸收水的质量为:2.5mol×116g/mol-250g=40g,
答:250g质量分数为98%的硫酸能吸收40g水;
(3)2934.4L氧气的物质的量为$\frac{2934.4L}{22.4L/mol}$=131mol,设Fe3O4与Fe2O3物质的量分别为amol,bmol,则$\left\{\begin{array}{l}{3a+2b=48}\\{8a+5.5b=131}\end{array}\right.$,解得:$\left\{\begin{array}{l}{a=4}\\{b=18}\end{array}\right.$,所以Fe3O4与Fe2O3物质的量之比4:18=2:9,
答:反应产物中Fe3O4与Fe2O3物质的量之比2:9;
(4)设混合所体为1体积,则硫化氢为0.84体积,
由2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O,
2 3 2 2
0.84 1.26 0.84 0.84
所以反应消耗的空气为:$\frac{1.26}{21%}$=6,而空气过量77%,所以一共所需空气为:6×1.77=10.62体积,所以φ(SO2)=$\frac{0.84}{10.62-1.26+1+0.84}$=0.075,
答:产物气体中SO2体积分数为0.075.
点评 本题考查化学方程式的有关计算,为高频考点,侧重考查学生分析计算能力,明确各个物理量关系是解本题关键,注意原子守恒的灵活运用,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化.
①已知部分化学键的键能如下
| 分子式/结构式 | NO/N≡O | CO/C≡O | CO2/O=C=O | N2/N≡N |
| 化学键 | N≡O | C≡O | C=O | N≡N |
| 键能(KJ/mol) | 632 | 1072 | 750 | 946 |
2NO(g)+2CO( g)?N2( g)+2CO2(9)△H=-538kJ/mol
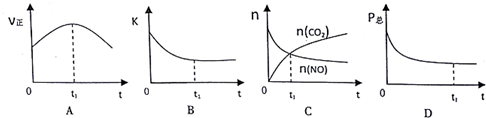
②若上述反应在恒温、恒容的密闭体系中进行,并在t.时刻达到平衡状态,则下列示意图
不符合题意的是ABC(填选项序号).(下图中V正、K、n、P总分别表示正反应速率、平衡常
数、物质的量和总压强)
(2)在t1℃下,向体积为10L的恒容密闭容器中通人NO和CO,测得了不同时间时NO和CO的物质的量如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/×10-2mol | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| n(CO)/×10-1mol | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
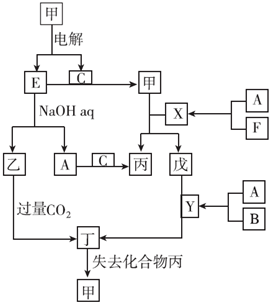
(3)如图l所示,以N2O4为原料采用电解法可制备新型绿色硝化剂(一种氮氧化物)写出生成这种硝化剂的阳极电极反应式N2O4+2HNO3-2e-=2N2O5+2H+.
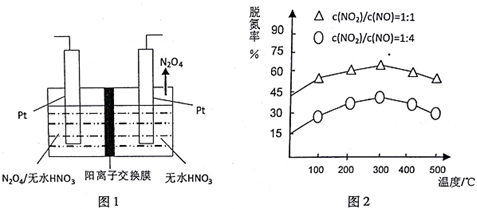
(4)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.在氨气足量的情况下,不同c(NO2)/C(NO)、不同温度对脱氮率的影响如图2所示(已知氨气催化还原氮氧化物的正反应为放热反应),请回答温度对脱氮率的影响300℃之前,温度升高脱氮率逐渐增大,而300℃之后,温度升高脱氮率逐渐减小,给出合理的解释:300℃之前,反应未平衡,反应向右进行,脱氮率增大;300℃时反应达平衡,后升温平衡逆向移动,脱氮率减小.
| A. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1010的溶液中:Na+ ${NH}_{4}^{+}$ HCO${\;}_{3}^{-}$ Cl- | |
| B. | 含有大量ClO-的溶液中:K+ OH- Na+ ${SO}_{3}^{2-}$ | |
| C. | c(Al3+)=0.1 mol?L-1的溶液中:Na+ NO${\;}_{3}^{-}$ AlO${\;}_{2}^{-}$ ${SO}_{4}^{2-}$ | |
| D. | 澄清透明的溶液中:Cu2+ Fe3+ NO${\;}_{3}^{-}$ Cl- |
| A. | 能使广泛pH试纸显蓝色的溶液:K+、Na+、CH3COO-、Br- | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- | |
| C. | 0.1 mol?L-1 FeCl3溶液:K+、NH4+、I-、SCN- | |
| D. | 由水电离的c (H+)=1×10-14 mol?L-1的溶液中:Ca2+、K+、Cl-、HCO${\;}_{3}^{-}$ |