题目内容
下列各组离子在溶液中能大量共存的是( )
| A、H+、Na+、HCO3-、Cl- |
| B、Cu2+、Na+、Cl-、SO42- |
| C、Mg2+、K+、SO42-、OH- |
| D、Ag+、Al3+、NO3-、Cl- |
考点:离子共存问题
专题:离子反应专题
分析:根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答:
解:A.H+、HCO3-结合生成水和气体,不能大量共存,故A不选;
B.该组离子之间不反应,可大量共存,故B选;
C.Mg2+、OH-结合生成沉淀,不能大量共存,故C不选;
D.Ag+、Cl-结合生成沉淀,不能大量共存,故D不选;
故选B.
B.该组离子之间不反应,可大量共存,故B选;
C.Mg2+、OH-结合生成沉淀,不能大量共存,故C不选;
D.Ag+、Cl-结合生成沉淀,不能大量共存,故D不选;
故选B.
点评:本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
下列分类标准不正确的是( )
| A、化学反应分为:离子反应、非离子反应(标准:是否在水溶液中进行) |
| B、分散系分为:溶液、胶体、浊液(标准:分散质粒子的大小) |
| C、化学反应分为:氧化还原反应、非氧化还原反应(标准:元素化合价是否发生变化) |
| D、化合物分为:电解质、非电解质(标准:溶于水或熔融状态能否导电) |
恒温恒容,下列物理量不再发生变化时,不能说明A(s)+3B(g)?2C(g)+D(g)已达平衡状态的( )
| A、混合气体的压强 |
| B、C的体积分数 |
| C、混合气体的密度 |
| D、混合气体的平均相对分子质量 |
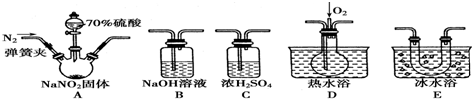
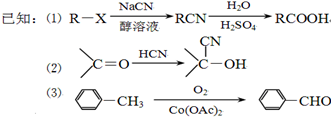
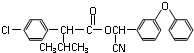 ):
):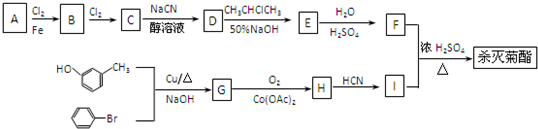
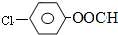 结构,则符合此条件的F共有
结构,则符合此条件的F共有

 和环状结构
和环状结构 是E的最简单的同系物.
是E的最简单的同系物.