题目内容
7. 氨和硝酸都是重要的化学品.
氨和硝酸都是重要的化学品.(1)画出采用氨催化氧化法合成硝酸的反应原理流程图:(要求注明试剂、反应条件)NH3$→_{高温O_{2}}^{催化剂}$NO$\stackrel{O_{2}}{→}$NO2$\stackrel{H_{2}O}{→}$HNO3
(示例:S$→_{O_{2}}^{燃烧}$SO2$→_{△O_{2}}^{催化剂}$SO3…)
(2)向饱和氯化钠和浓氨水的混合溶液中通入过量CO2从而析出NaHCO3晶体,是侯氏制碱法的关键步骤,用一个化学方程式表示该反应原理NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl.在0.1mol/L的稀氨水中,下列式子成立的是AD.
A.c(NH3•H2O)+c(NH3)+c(NH4+)=0.1mol/L
B.c(NH3•H2O)>c(NH3)+c(NH4+)
C.c(H+)>c(OH-)
D.c(NH4+)+c(H+)=c(OH-)
(3)A是中学化学常见气体,打开装有A的集气瓶,瓶口出现白雾,将A与氨气混合,立即出现大量白烟,生成物质B,则A的分子式为HCl,物质B中所含的化学键类型有极性共价键、离子键、配位键.
(4)将6.4g铜粉投入一定量的浓硝酸中,铜完全溶解,产生标准状况下的混合气体3.36L,其中两种成分气体的体积比为1:5,反应中总共消耗的硝酸0.35mol.
(5)向含4mol HNO3的稀溶液中,逐渐加入铁粉至过量.假设生成的气体只有一种,请在坐标系中画出n(气体)随n(Fe)变化的示意图,并标出n(气体)的最大值.
(6)氨气和硝酸生产的氮肥硝酸铵受热或受撞击容易分解,若分解时只生成两种氧化物,写出该反应的化学方程式NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$N2O↑+2H2O.
分析 (1)氨催化氧化法合成硝酸的反应原理是氨气催化氧化生成一氧化氮,一氧化氮和氧气反应生成二氧化氮,二氧化氮溶于水生成硝酸和一氧化氮;
(2)向饱和氯化钠和浓氨水的混合溶液中通入过量CO2从而析出NaHCO3晶体,得到氯化铵溶液;在0.1mol/L的稀氨水中存在电离平衡和化学平衡,NH3+H2O?NH3•H2O?NH4++OH-,溶液中存在物料守恒和电荷守恒,据此分析;
(3)A是中学化学常见气体,打开装有A的集气瓶,瓶口出现白雾,将A与氨气混合,立即出现大量白烟为氯化铵固体颗粒,A气体为HCl气体,氯化铵为离子化合物;
(4)设NO和NO2的物质的量分别为xmol、ymol,根据二者总体积、电子转移守恒列方程,再根据在相同状态下,气体的体积之比等于物质的量之比来求算;根据守恒,硝酸的物质的量为:2n(Cu)+n(NO)+n(NO2)‘
(5)向含4mol HNO3的稀溶液中,逐渐加入铁粉至过量,发生的反应为Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,Fe+2Fe(NO3)3=3Fe(NO3)2,生成气体最大为1mol,消耗铁1mol,据此画出图象;
(6)硝酸铵中含有氮、氢、氧三种元素,根据质量守恒定律中元素种类不变的特点可知生成的另一种氧化物中含有氢元素,即该氧化物是水,因此硝酸铵在撞击条件下反应生成一氧化二氮和水.
解答 解:(1)氨催化氧化法合成硝酸的反应原理是氨气催化氧化生成一氧化氮,一氧化氮和氧气反应生成二氧化氮,二氧化氮溶于水生成硝酸和一氧化氮,流程图为:NH3$→_{高温O_{2}}^{催化剂}$NO$\stackrel{O_{2}}{→}$NO2$\stackrel{H_{2}O}{→}$HNO3,
故答案为:NH3$→_{高温O_{2}}^{催化剂}$NO$\stackrel{O_{2}}{→}$NO2$\stackrel{H_{2}O}{→}$HNO3;
(2)向饱和氯化钠和浓氨水的混合溶液中通入过量CO2从而析出NaHCO3晶体,得到氯化铵溶液,反应的化学方程式为:NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl,
在0.1mol/L的稀氨水中存在电离平衡,
A.溶液中存在物料守恒即氮元素守恒,c(NH3•H2O)+c(NH3)+c(NH4+)=0.1mol/L,故A正确;
B.溶液中溶质主要是一水合氨,一水合氨存在化学平衡和电离平衡,NH3+H2O?NH3•H2O?NH4++OH-,c(NH3•H2O)>c(NH3)+c(NH4+),故B正确;
C.一水合氨电离NH3•H2O?NH4++OH-,是弱碱c(H+)<c(OH-),故C错误;
D.溶液中存在电荷守恒,c(NH4+)+c(H+)=c(OH-),故D正确;
故答案为:NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl; ABD;
(3)A是中学化学常见气体,打开装有A的集气瓶,瓶口出现白雾,将A与氨气混合,立即出现大量白烟为氯化铵固体颗粒,NH3+HCl=NH4Cl,A气体为HCl气体,氯化铵为离子化合物,铵根离子中含极性共价键、配位键,铵根离子和氯离子间形成离子键,
故答案为:HCl;极性共价键、离子键、配位键;
(4)6.4g铜的物质的量为$\frac{6.4g}{64g/mol}$=0.1mol,在反应中失去的电子的物质的量为2×0.1mol=0.2mol,3.36L混合气体的物质的量为$\frac{3.36L}{22.4L/mol}$=0.15mol
令NO和NO2的物质的量分别为xmol、ymol,则:
x+y=0.15mol ①
3x+y=0.1mol×2 ②
解得x=0.025,y=0.125,
在相同状态下,气体的体积之比等于物质的量之比,故生成的NO和NO2的体积之比为0.025:0.125=1:5,
根据元素守恒,硝酸的物质的量为:2n(Cu)+n(NO)+n(NO2)=0.1mol×2+$\frac{1}{6}$×0.15mol+$\frac{5}{6}$×0.15=0.35mol,
故答案为:1:5;0.35;
(5)向含4mol HNO3的稀溶液中,逐渐加入铁粉至过量,发生的反应为Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,Fe+2Fe(NO3)3=3Fe(NO3)2,生成气体最大为1mol,消耗铁1mol,n(气体)随n(Fe)变化的图象为: ,
,
故答案为:
(6)硝酸铵中含有氮、氢、氧三种元素,根据质量守恒定律中元素种类不变的特点可知生成的另一种氧化物中含有氢元素,即该氧化物是水,因此硝酸铵在撞击条件下反应生成一氧化二氮和水,该反应的化学方程式为:NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$N2O↑+2H2O.
故答案为:NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$N2O↑+2H2O.
点评 本题考查了氮及其化合物性质,氧化还原反应电子守恒计算,图象绘制等知识,掌握基础是解题关键,题目难度中等.

 名校课堂系列答案
名校课堂系列答案a.分子直径的大小 b.分子间距离的大小
c.分子间的引力大小 d.分子数目的大小.
| A. | a、b | B. | b、c | C. | a、d | D. | b、d |
| A. | L层上的电子数为奇数的元素一定是主族元素 | |
| B. | 族序数等于周期序数的元素一定是金属元素 | |
| C. | 由不同种元素组成的多原子分子里,一定只存在极性键 | |
| D. | 共价化合物只含有共价键,离子化合物只含有离子键 |
| A. | SO2、CO2性质相似,都能在水溶液中被氯气氧化 | |
| B. | Na2O2、Na2O组成元素相同,与CO2反应产物也相同 | |
| C. | Mg和K在一定条件下与水反应都生成H2和对应的碱 | |
| D. | Na、Li同属于碱金属单质,在加热条件下与氧气反应都生成过氧化物 |
| A. | 液氯 | B. | 漂白粉 | C. | 臭氧 | D. | 白酒、 |
 实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸浓度的实验;请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸浓度的实验;请完成下列填空:(1)配制100mL0.10mol•L-1NaOH标准溶液.
①配制所需的玻璃仪器有:烧杯、量筒、玻璃棒、100mL容量瓶、胶头滴管等.
②称取0.4g氢氧化钠固体所需仪器有天平(带砝码、镊子)、药匙、烧杯.
(2)取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用碱式滴定管(填仪器名称)装配制的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
| 滴定次数 | 待测盐酸的体积(mL) | 标准NaOH溶液体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 20.00 | 0.40 | 20.50 |
| 第二次 | 20.00 | 4.10 | 24.00 |
| 第三次 | 20.00 | 1.00 | 24.00 |
②根据上述数据,可计算出该盐酸的浓度约为0.10 mol/L(保留小数点后二位数).
③给润洗后的滴定管中注入溶液时应C(填序号)
A.借助于漏斗 B.借助于玻璃棒 C.借助于烧杯 D.直接注入
④排去碱式滴定管中气泡的方法应采用下图操作丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
⑤在上述实验中,下列操作(其他操作正确)会造成测定结果偏低的有AD
D.滴定终点读数时俯视读
A.酸式滴定管使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体中混有Na2CO3固体
E.碱式滴定管尖嘴部分有气泡,滴定后消失.
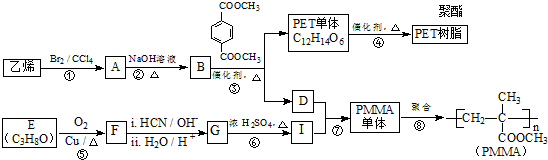
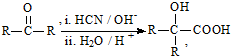 (R、R′代表烃基)
(R、R′代表烃基) .
. .
. .
.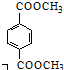 与足量NaOH溶液反应时,最多消耗4molNaOH
与足量NaOH溶液反应时,最多消耗4molNaOH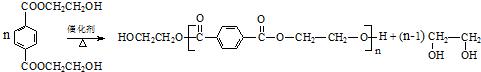 .
. 氨氧化法是工业生产中制取硝酸的主要途径,某同学用该原理在实验室探究硝酸的制备和性质,设计了如图所示的装置.
氨氧化法是工业生产中制取硝酸的主要途径,某同学用该原理在实验室探究硝酸的制备和性质,设计了如图所示的装置.