题目内容
6.0.2mol某烃A在氧气中完全燃烧后,生成CO2和H2O各1.2mol.试回答:(1)烃A的分子式为C6H12.
(2)若取一定量的烃A完全燃烧后,生成CO2和H2O各3mol,则有42g烃A参加了反应.
(3)若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,烃A可能有3 种结构
(4)比烃A少一个碳原子且能使溴水褪色的A的同系物有5种同分异构体.
分析 (1)烃燃烧生成二氧化碳和水,由0.2mol烃燃烧生成二氧化碳和水各1.2mol可知有机物的分子式为C6H12;
(2)由分子组成可知,生成CO2和H2O各3mol,烃为0.5mol,可确定烃的质量;
(3)烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,说明烃中含有C=C,其中,含有4个甲基的有3种,其碳架结构为(①②③处可分别不同时安排双键): ,以此确定烯烃;
,以此确定烯烃;
(4)比烃A少一个碳原子且能发生反应而使溴水褪色的A为戊烯,先找出碳链异构,然后计算出加入双键后的种类.
解答 解:(1)某烃A 0.2mol 在氧气中完全燃烧后,生成CO2和H2O各1.2mol,则分子中含有N(C)=6,n(H)=12,分子式为C6H12,
故答案为:C6H12;
(2)若取一定量的该烃A完全燃烧后,生成CO2和H2O各3mol,由分子组成可知烃为0.5mol,质量为0.5mol×(84g/mol)=42g,
故答案为:42;
(3)烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,说明烃中含有C=C,其中,含有4个甲基的有3种,其碳架结构为(①②③处可分别不同时安排双键): ,烃A可能有的结构简式为(CH3)3C-CH=CCH2、CH3-C(CH3)=C(CH3)-CH3、CH3CH(CH3)-C(CH3)=CH2等,共3种;
,烃A可能有的结构简式为(CH3)3C-CH=CCH2、CH3-C(CH3)=C(CH3)-CH3、CH3CH(CH3)-C(CH3)=CH2等,共3种;
故答案为:3;
(4)比烃A少一个碳原子且能发生反应而使溴水褪色,说明含有碳碳双键,所以A为戊烯,
碳架异构有三种:主链5个碳原子:C-C-C-C-C:加入双键方式有2种,分别为:CH2=CH-CH2-CH2-CH3、CH3-CH=CH-CH2-CH3,
主链四个碳原子 ,加入双键方式有3种,分别为CH2=C(CH3)-CH2-CH3、CH3-C(CH3)=CH-CH3、CH3-CH(CH3)-CH=CH2,
,加入双键方式有3种,分别为CH2=C(CH3)-CH2-CH3、CH3-C(CH3)=CH-CH3、CH3-CH(CH3)-CH=CH2,
主链三个碳原子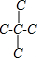 ,由于中间的碳原子达到饱和,不可能存在碳碳双键,
,由于中间的碳原子达到饱和,不可能存在碳碳双键,
所以总共存在5种戊烯的同分异构体,
故答案为:5.
点评 本题考查有机物的推断,为高频考点,侧重于学生的分析、计算能力的考查,题目难度中等,注意把握物质的结构和性质的关系,把握同分异构体的判断方法,学习中注意有机物官能团的性质.

| A. | NH4+ | B. | CH4 | C. | SO2 | D. | CO2 |
| 物质序号 | 被提纯物(杂质) | 试剂 | 分离方法 |
| ① | CH3CH3(CH2=CH2) | ||
| ② | CH2=CH2(SO2) | ||
| ③ | 乙酸乙酯(乙酸) | ||
| ④ | 乙醇(水) |
步骤1:准确称取该晶体0.9820g,配成溶液,平均分成10份.
步骤2:取一份溶液,酸化,加热,用SnCl2-TiCl3将Fe3+全部还原为Fe2+,再加0.0100mol•L-1KMnO4至恰好反应,将C2O42-全部氧化成CO2,Fe2+全部氧化成Fe3+,消耗KMnO4体积28.00mL.
步骤3:另取一份溶液,酸化,加入0.0100mol•L-1KMnO4至恰好反应完全,将C2O42-全部氧化成CO2,消耗KMnO4体积24.00mL.
(已知:MnO${\;}_{4}^{-}$还原产物为Mn2+,上述实验数据为多次实验有效数据平均值)
下列判断正确的是( )
| A. | 取溶解后待测液少许,先加少量氯水,再加KSCN产生血红色溶液,则有Fe2+ | |
| B. | 步骤3的离子方程式为:5C2O42-+2MnO${\;}_{4}^{-}$+8H2O=10CO2↑+2Mn2++16OH- | |
| C. | x:z=1:2 | |
| D. | 该晶体的化学式为:K3[Fe(C2O4)3]•3H2O |
Ⅰ.用AXnEm表示只含一个中心原子的分子组成,A为中心原子,X为与中心原子相结合的原子,E为中心原子最外层未参与成键的电子对(称为孤电子对),(n+m)称为价层电子对数.分子中的价层电子对总是互相排斥,均匀地分布在中心原子周围的空间;
Ⅱ.分子的空间构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤电子对;
Ⅲ.分子中价层电子对之间的斥力主要顺序为:
ⅰ.孤电子对之间的斥力>孤电子对与共用电子对之间的斥力>共用电子对之间的斥力;ⅱ.双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;ⅲ.X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强;ⅳ.其他.请仔细阅读上述材料,回答下列问题:
(1)根据要点Ⅰ可以画出AXnEm的VSEPR理想模型,请填写下表:
| n+m | 2 | |
| VSEPR理想模型 | 正四面体形 | |
| 价层电子对 之间的理想键角 | 109°28′ |
(3)用价层电子对互斥理论(VSEPR)判断下列分子或离子的空间构型:
| 分子 | |||
| 或离子 | SnCl2 | CCl4 | ClO${\;}_{4}^{-}$ |
| 立体构型 |
| A. | Ca(OH)2 | B. | NaOH | C. | NaHCO3 | D. | Na2CO3 |
| A. | ①>②>③>④>⑤ | B. | ②>①>⑤>④>③ | C. | ③>④>⑤>①>② | D. | ⑤>④>③>②>① |