题目内容
1.已知H2O2(aq)有酸性,也有漂白作用,它在MnO2的催化下可以加速分解:①2H2O2═2H2O+O2↑
某学生查阅资料后指出Na2O2与水反应时,先生成NaOH和H2O2:
②Na2O2+2H2O═2NaOH+H2O2
此反应放出的热量,促使H2O2缓慢分解,生成O2:
③2H2O2═2H2O+O2↑
该过程的总反应方程式即为:
④2Na2O2+2H2O═4NaOH+O2↑
该同学所在的课外兴趣小组欲验证他的以上认识,实验室提供了下列仪器和?药品:?
仪器:试管、胶头滴管、烧杯、药匙、镊子
药品:Na2O2、水、酚酞试液、石蕊试液、MnO2
假设你是该课外活动小组的成员,请你简述实验过程,并写出实验现象和实验?结论.
分析 该实验的目的是验证Na2O2与水反应时,先生成NaOH和H2O2,后过氧化氢分解,须设置对比实验,一实验在③反应发生前放入酚酞,检验氢氧化钠的存在,二实验在③反应发生后放入酚酞(可利用MnO2促使H2O2完全分解);若一实验先变红后褪色,二实验只变红不褪色,则表明该同学认识正确,反之不正确.
解答 解:该实验的目的是验证Na2O2与水反应时,先生成NaOH和H2O2,后过氧化氢分解,须设置对比实验,具体操作为:①用药匙取少量过氧化钠固体加入试管中;②再逐滴加入水到不再产生气体,加适量水稀释;③将溶液一分为二,向一支试管中滴2滴酚酞试液,溶液先变红,约半分钟后红色褪去,证明发生Na2O2+2H2O═2NaOH+H2O2,有碱生成,约半分钟后红色褪去,证明有漂白性的过氧化氢生成,向另一支试管中先加少量MnO2,先有气体放出2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,待反应完成后,再加酚酞1~2滴,溶液变红色,并持久不褪色有碱生成,由此说明该同学的观点正确.若没有以上现象,则不正确.
答:①用药匙取少量过氧化钠固体加入试管中;②再逐滴加入水到不再产生气体,加适量水稀释;③将溶液一分为二,向一支试管中滴2滴酚酞试液,溶液先变红,约半分钟后红色褪去;向另一支试管中先加少量MnO2,先有气体放出,待反应完成后,再加酚酞1~2滴,溶液变红色,并持久不褪色,由此说明该同学的观点正确.若没有以上现象,则不正确.
点评 本题较好再现了科学探究的一般过程,考查了同学们思维的严密性,要做好此类题,同学们要明了课本上一些重要实验的设计思路和原理,题目难度中等.

练习册系列答案
相关题目
5.下列有关说法正确的是( )
| A. | 可用分液漏斗分离乙醛与水的混合物 | |
| B. | 可用溴水一次全部鉴别出苯、乙醇、1-己烯、福尔马林和苯酚溶液 | |
| C. | 提纯苯甲酸(含有食盐固体)可采用溶解、过滤、蒸馏的方法 | |
| D. | 煤油、柴油、花生油、猪油的主要成分均为酯类 |
6.下列物质中属于天然高分子化合物的是( )
| A. | 油脂 | B. | 棉花 | C. | 氨基酸 | D. | 聚乙烯 |
3.下列表述正确的是( )
| A. | 一氯甲烷的结构式:CH3Cl | B. | 苯的分子式: | ||
| C. | 葡萄糖的结构简式:C6H12O6 | D. | 丙烷分子的球棍模型: |
13.下列反应属于吸热反应的是( )
| A. | Mg与盐酸反应 | B. | NH4Cl的分解反应 | ||
| C. | Na在Cl2燃烧 | D. | NaOH溶液与CH3COOH溶液反应 |
10.充分灼烧a g某含C、H、O元素的有机物时,测得生成了b g CO2和c g H2O,则以下判断正确的是( )
| A. | 肯定不能确定该物质的最简式 | B. | 肯定能确定该物质的最简式 | ||
| C. | 肯定不能确定该物质的分子式 | D. | 肯定不能确定该物质的结构式 |
11.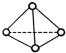 科学家己获得了极具理论研究意义的N4分子,其结构为正四面体型(如图所示),分子中每个氮原子最外电子层都满足8电子结构.己知断裂1mol N-N键吸收192kJ热量,断梨1mol N-N键吸收946kJ热量,则下列叙述中正确的是( )
科学家己获得了极具理论研究意义的N4分子,其结构为正四面体型(如图所示),分子中每个氮原子最外电子层都满足8电子结构.己知断裂1mol N-N键吸收192kJ热量,断梨1mol N-N键吸收946kJ热量,则下列叙述中正确的是( )
 科学家己获得了极具理论研究意义的N4分子,其结构为正四面体型(如图所示),分子中每个氮原子最外电子层都满足8电子结构.己知断裂1mol N-N键吸收192kJ热量,断梨1mol N-N键吸收946kJ热量,则下列叙述中正确的是( )
科学家己获得了极具理论研究意义的N4分子,其结构为正四面体型(如图所示),分子中每个氮原子最外电子层都满足8电子结构.己知断裂1mol N-N键吸收192kJ热量,断梨1mol N-N键吸收946kJ热量,则下列叙述中正确的是( )| A. | 1molN4气体转化为N2时要吸收206 kJ能量 | |
| B. | N4是一种比N2更稳定的分子 | |
| C. | 1molN4气体转化为N2时要放出740 kJ能量 | |
| D. | N4是N2的同位素 |
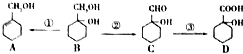 已知有机物A、B、C、D在一定条件下有如图所示的转化关系:
已知有机物A、B、C、D在一定条件下有如图所示的转化关系: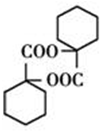 、
、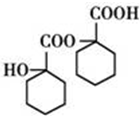 .
.