题目内容
11.2mol甲烷完全和氯气发生取代反应,生成四种取代产物的物质的量相同,则消耗氯气的物质的量为( )| A. | 5mol | B. | 4mol | C. | 6mol | D. | 3.5mol |
分析 根据四种取代物的物质的量相等结合碳原子守恒计算取代物的物质的量,再根据被取代的氢原子和氯气分子之间的关系式计算消耗氯气的物质的量.
解答 解:甲烷和氯气在光照条件下发生反应,生成有机物有CH3Cl、CH2Cl2、CHCl3、CCl4,HCl,1mol甲烷完全与氯气发生取代反应,若生成相同物质的量的四种取代物,所以每种取代物的物质的量是0.25mol,甲烷和氯气的取代反应中,被取代的氢原子的物质的量与氯气的物质的量相等,所以
生成0.25mol一氯甲烷需要氯气0.25mol氯气,
生成0.25mol二氯甲烷需要氯气0.5mol,
生成0.25mol三氯甲烷需要氯气0.75mol氯气,
生成0.25mol四氯化碳需要氯气1mol,
所以总共消耗氯气的物质的量=0.25mol+0.5mol+0.75mol+1mol=2.5mol,所以2mol甲烷完全和氯气发生取代反应,生成四种取代产物的物质的量相同,则消耗氯气的物质的量为5mol,
故选A.
点评 本题考查了甲烷的取代反应,明确甲烷的取代反应中被取代的氢原子和氯气之间的关系是解本题的关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.用VSEPR模型预测下列分子或离子的立体结构,其中正确的是( )
| A. | H2O与BeCl2为角形(V形) | B. | CS2与SO2为直线形 | ||
| C. | BF3与PCl3为三角锥形 | D. | SO3与CO${\;}_{3}^{2-}$为平面三角形 |
19.下列说法正确的是( )
| A. | 增大压强,单位体积活化分子数一定增加,化学反应速率一定增大 | |
| B. | 升高温度,活化分子百分数增加,化学反应速率一定增大 | |
| C. | 加入反应物,使活化分子百分数增加,化学反应速率增大 | |
| D. | 使用催化剂,一定降低了反应的活化能,化学反应速率一定增大 |
6.下列分子组成中的所有原子不可能在同一平面上的是( )
| A. | 乙炔 | B. | 苯 | C. | 乙烯 | D. | 丙烷 |
16.制取水处理剂ClO2的化学方程式为:2KClO3+H2C2O4+H2SO4═2ClO2↑+K2SO4+2CO2↑+2H2O.下列说法不正确的是( )
| A. | KClO3在反应中得到电子 | |
| B. | ClO2是还原产物 | |
| C. | H2C2O4在反应中被还原 | |
| D. | 1molKClO3参加反应有1mol电子转移 |
3.Na2FeO4是一种高效多功能水处理剂,应用前景十分看好.一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中正确的是( )
| A. | Na2O2只作氧化剂 | |
| B. | 2 mo l FeSO4发生反应时,反应中共有8 mol电子转移 | |
| C. | FeSO4为还原剂 | |
| D. | 铁元素被还原,氧元素被氧化 |
20.下列实验装置或实验操作正确的是( )
| A. | 制取蒸馏水时,温度计的水银球应插入蒸馏烧瓶的溶液中 | |
| B. | 稀释浓硫酸时,应将水缓缓地加入浓硫酸中并不断搅拌 | |
| C. | 萃取水中碘单质时,萃取剂的密度应大于水的密度 | |
| D. | 分液时,下层液体需从分液漏斗下口流出,上层液体应从上口倒出 |
1.某元素的原子结构示意图为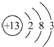 ,下列关于该元素的说法中,错误的是( )
,下列关于该元素的说法中,错误的是( )
 ,下列关于该元素的说法中,错误的是( )
,下列关于该元素的说法中,错误的是( )| A. | 它是一种金属元素 | B. | 它的阳离子有10个质子 | ||
| C. | 它的阳离子带3个单位正电荷 | D. | 其原子核外有13个电子 |