题目内容
某氯化亚铁和氯化铁的混合物.现要测定其中铁元素的质量分数,进行如下实验:
Ⅰ.甲同学根据如下流程进行实验,回答以下问题:

(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 (填仪器名称).
(2)请写出加入溴水发生的离子反应方程式 .
(3)将沉淀物置于坩埚中加热至恒重后,冷却至室温,称量剩余固体和坩埚的质量,计算.
实验中加热至恒重的目的是 .
(4)若坩埚质量是W1g,坩埚与加热后固体总质量是W2g,则样品中铁元素的质量分数是 .
Ⅱ.乙同学提出,还可以采用以下方法来测定:
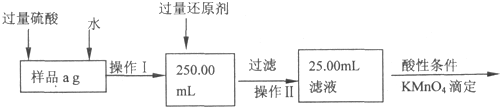
(1)溶解样品改用了硫酸,用离子方程式指明不再用盐酸原因是 ;
(2)若要用实验证明操作Ⅱ所得滤液中不存在Fe3+,其最可靠的化学方法是 ;
(3)若滴定用掉c mol/L KMn04溶液b mL,则样品中铁元素的质量分数是 .
Ⅰ.甲同学根据如下流程进行实验,回答以下问题:

(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有
(2)请写出加入溴水发生的离子反应方程式
(3)将沉淀物置于坩埚中加热至恒重后,冷却至室温,称量剩余固体和坩埚的质量,计算.
实验中加热至恒重的目的是
(4)若坩埚质量是W1g,坩埚与加热后固体总质量是W2g,则样品中铁元素的质量分数是
Ⅱ.乙同学提出,还可以采用以下方法来测定:

(1)溶解样品改用了硫酸,用离子方程式指明不再用盐酸原因是
(2)若要用实验证明操作Ⅱ所得滤液中不存在Fe3+,其最可靠的化学方法是
(3)若滴定用掉c mol/L KMn04溶液b mL,则样品中铁元素的质量分数是
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:Ⅰ、(1)根据配制一定物质的量浓度的溶液所需要的仪器有:量筒、胶头滴管、烧杯、玻璃棒、一定规格的容量瓶;
(2)根据Br2具有氧化性,能氧化Fe2+;为了使Fe3+充分沉淀,氨水要过量;
(3)为了减少误差,需再次加热冷却并称量,直至两次质量差小于0.1g,使氢氧化铁全部分解;
(4)根据铁元素质量守恒,即红棕色固体( Fe2O3)中的铁就是样品中铁,根据质量分数的公式求出铁元素的质量分数;
Ⅱ、(1)溶解样品若用盐酸,用高锰酸钾若用滴定时会氧化氯离子,影响实验测定结果;
(2)检验是否存在亚铁离子不存在铁离子,依据铁离子的检验方法,遇到硫氰酸钾溶液是否变红色设计验证;
(3)依据高锰酸钾和亚铁离子的氧化还原反应定量关系计算.
(2)根据Br2具有氧化性,能氧化Fe2+;为了使Fe3+充分沉淀,氨水要过量;
(3)为了减少误差,需再次加热冷却并称量,直至两次质量差小于0.1g,使氢氧化铁全部分解;
(4)根据铁元素质量守恒,即红棕色固体( Fe2O3)中的铁就是样品中铁,根据质量分数的公式求出铁元素的质量分数;
Ⅱ、(1)溶解样品若用盐酸,用高锰酸钾若用滴定时会氧化氯离子,影响实验测定结果;
(2)检验是否存在亚铁离子不存在铁离子,依据铁离子的检验方法,遇到硫氰酸钾溶液是否变红色设计验证;
(3)依据高锰酸钾和亚铁离子的氧化还原反应定量关系计算.
解答:
解:Ⅰ、(1)因配制一定物质的量浓度的溶液所需要的仪器有:量筒、胶头滴管、烧杯、玻璃棒、一定规格的容量瓶,该实验需要250mL容量瓶,
故答案为:250mL容量瓶;胶头滴管;
(2)因Br2具有氧化性,能氧化Fe2+:2Fe2++Br2=2Fe3++2Br-;为了使Fe3+充分沉淀,氨水要过量,故答案为:2Fe2++Br2=2Fe3++2Br-;
(3)为了减少误差,需再次加热冷却并称量,直至两次质量差小于0.1g,实验中加热至恒重的目的是使Fe(OH)3分解完全,故答案为:使Fe(OH)3分解完全;
(4)因铁元素质量守恒,即红棕色固体中的铁就是样品中铁,Fe2O3中铁元素的质量为(W2-W1)g×
;样品中铁元素的质量分数是
×100%=
×100%,
故答案为:
×100%;
Ⅱ.(1)高锰酸钾具有强氧化性,加入盐酸,溶液中的氯离子会被氧化,多消耗高锰酸钾,产生实验测定误差,2MnO4-+16H++10Cl-=2Mn2++5Cl2+8H2O;
故答案为:2MnO4-+16H++10Cl-=2Mn2++5Cl2+8H2O;
(2)若要用实验证明操作Ⅱ所得滤液中不存在Fe3+,其最可靠的化学方法是取少量滤液于试管中,滴加1~2滴KSCN溶液,溶液不变红;
故答案为:取少量滤液于试管中,滴加1~2滴KSCN溶液,溶液不变红;
(3)设铁元素质量分数为X%,
5Fe2+~5Fe3+~KMnO4
5×56 1
a×X%×
c×b×10-3
铁元素的质量分数是X%=
,
故答案为:
.
故答案为:250mL容量瓶;胶头滴管;
(2)因Br2具有氧化性,能氧化Fe2+:2Fe2++Br2=2Fe3++2Br-;为了使Fe3+充分沉淀,氨水要过量,故答案为:2Fe2++Br2=2Fe3++2Br-;
(3)为了减少误差,需再次加热冷却并称量,直至两次质量差小于0.1g,实验中加热至恒重的目的是使Fe(OH)3分解完全,故答案为:使Fe(OH)3分解完全;
(4)因铁元素质量守恒,即红棕色固体中的铁就是样品中铁,Fe2O3中铁元素的质量为(W2-W1)g×
| 112 |
| 160 |
| ||
| a |
| 7(W2-W1) |
| a |
故答案为:
| 7(W2-W1) |
| a |
Ⅱ.(1)高锰酸钾具有强氧化性,加入盐酸,溶液中的氯离子会被氧化,多消耗高锰酸钾,产生实验测定误差,2MnO4-+16H++10Cl-=2Mn2++5Cl2+8H2O;
故答案为:2MnO4-+16H++10Cl-=2Mn2++5Cl2+8H2O;
(2)若要用实验证明操作Ⅱ所得滤液中不存在Fe3+,其最可靠的化学方法是取少量滤液于试管中,滴加1~2滴KSCN溶液,溶液不变红;
故答案为:取少量滤液于试管中,滴加1~2滴KSCN溶液,溶液不变红;
(3)设铁元素质量分数为X%,
5Fe2+~5Fe3+~KMnO4
5×56 1
a×X%×
| 25.00 |
| 250.0 |
铁元素的质量分数是X%=
| 2.8bc |
| a |
故答案为:
| 2.8bc |
| a |
点评:本题主要考查了铁元素的质量分数的测定,实验分析,实验数据的计算应用,同时考查了实验知识的分析判断,难度不大.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
实验室中电解饱和氯化钠溶液时,不能直接得到的物质是( )
| A、氯气 | B、氢气 |
| C、氢氧化钠 | D、氯化氢 |
下列事实不能用电化学理论解释的是( )
| A、轮船水线以下的船壳上装一定数量的锌块 |
| B、铁可以在氯气中燃烧 |
| C、纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快 |
| D、镀锌的铁比镀锡的铁耐用 |
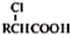 ,写出以苯酚、乙醇和乙酸为原料制备
,写出以苯酚、乙醇和乙酸为原料制备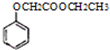 的合成路线流程图(无机试剂任用).合成路线流程图例如下:
的合成路线流程图(无机试剂任用).合成路线流程图例如下: ,请写出设计合成实验时所涉及的有机反应类型:
,请写出设计合成实验时所涉及的有机反应类型: