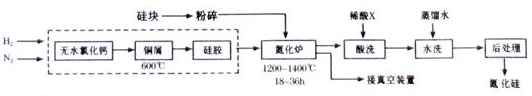
题目内容
5.下列说法中,不正确的是( )| A | B | C | D |
 |  |  | 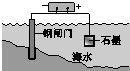 |
| 钢铁表面水膜的酸性很弱或呈中性,发生吸氧腐蚀 | 钢铁表面水膜的酸 性较强,发生析氢 腐蚀 | 将锌板换成铜板对 钢闸门保护效果更好 | 钢闸门作为阴极而受到保护 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.当钢铁表面的水膜酸性很弱或显中性时,氧气在正极上放电;
B.当钢铁表面的水膜显酸性时,水膜中的氢离子在正极放电;
C.在原电池中,正极被保护;
D.在电解池中,阴极被保护.
解答 解:A.当钢铁表面的水膜酸性很弱或显中性时,铁在负极放电,氧气在正极上放电,发生的是钢铁的吸氧腐蚀,故A正确;
B.当钢铁表面的水膜显酸性时,铁在负极放电,水膜中的氢离子在正极放电生成氢气,发生的是析氢腐蚀,故B正确;
C.在原电池中,正极被保护,当将锌板换成铜板后,铜做正极被保护,钢闸门做负极被腐蚀,起不到对钢闸门的保护作用,故C错误;
D.在电解池中,阴极被保护,故要保护钢闸门,就要将钢闸门做电解池的阴极,故D正确.
故选C.
点评 本题考查了钢铁的电化学腐蚀和防护等问题,为高频考点,侧重于学生的分析能力的考查,应注意的是要将被保护的金属做原电池的正极或电解池的阴极,难度不大.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
15.下列有关热化学方程式的叙述正确的是( )
| A. | 2H2(g)+O2(g)═2H2O(g)△H=+483.6 kJ/mol | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ/mol | |
| D. | 己知2C(s)+2O2(g)═2CO2(g)△H1 2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
13.下列数值等于阿伏加德罗常数值的是( )
| A. | 1 mol羟基(-OH)中所含共价键数 | |
| B. | 1molHCl与KClO3反应生成0.5molCl2转移的电子数 | |
| C. | 1.8 g H2O中所含有的质子数、电子数、中子数 | |
| D. | 常温常压下,22.4LNO和CO混合气体中的O原子个数 |
20.分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是( )
| A. | 冰醋酸、纯碱、铜绿、生石灰分别属于酸、碱、盐、氧化物 | |
| B. | HClO、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸 | |
| C. | Al、Al2O3、Al(OH)3均既能与盐酸反应又能与氢氧化钠反应,都属于两性化合物 | |
| D. | H2SO4、NaOH、AlCl3均为强电解质,都属于离子化合物 |
17.0.5molCH4完全燃烧生成CO2和H2O(l)时放出445kJ热量,则下列热化学方程式正确的是( )
| A. | 2CH4(g)+4O2(g)═2CO2(g)+4H2O(l)△H=+890kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=890kJ•mol-1 | |
| D. | $\frac{1}{2}$ CH4(g)+O2(g)═$\frac{1}{2}$CO2(g)+H2O(l)△H=-445kJ•mol-1 |
14.下列事实得出的结论正确的是( )
| 事实 | 结论 | |
| A | HClO与H2SO3反应生成H2SO4和HCl | 非金属性:Cl>S |
| B | N2比白磷稳定得多 | 非金属性:P>N |
| C | 在约800℃时,金属钠可从熔融的KCl中置换出K | 金属性:Na>K |
| D | 工业上电解Na2AlF6和Al2O3的熔融混合物得到Al | 金属活动性:Na>Al |
| A. | A | B. | B | C. | C | D. | D |
18.常温下,下列微粒能在相应溶液中大量共存的是( )
| A. | 稀硫酸中:K+、MnO4-、CH3CH2OH | |
| B. | pH=11的溶液中:Na+、CO32-、NH3•H2O | |
| C. | 中性溶液中:Na+、NO3-、AlO2- | |
| D. | FeCl3溶液中:H2O2、Mg2+、SO42- |