题目内容
7.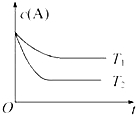 反应A(g)?B(g)+C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol•L-1.温度T1和T2下A的浓度与时间关系如图所示.回答下列问题:
反应A(g)?B(g)+C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol•L-1.温度T1和T2下A的浓度与时间关系如图所示.回答下列问题:(1)上述反应的温度(填“大于”“小于”或“等于”,下同)T1小于T2,平衡常数K(T1)小于K(T2).
(2)若温度T2时,2min后反应达到平衡,A的转化率为60%,则:
①平衡时体系总的物质的量为0.08mol.
②反应的平衡常数K=0.045mol/L.
③反应在0~2min区间的平均反应速率v(A)=0.015mol/(L.min).
分析 (1)温度越高达平衡所需的时间越短,然后结合图象分析反应的热效应,从而得出K的变化情况;
(2)根据三行式,结合平衡常数和反应速率的公式来求解.
解答 解:(1)由图可知T2先达平衡状态,所以T1小于T2,而温度越高K越小,所以正反应为吸热反应,所以温度越高K值越大,故答案为:小于;小于;
(2)A(g)?B(g)+C(g)
起始浓度:0.050 0 0
变化浓度:0.03 0.03 0.03
平衡浓度:0.02 0.03 0.03
①平衡时体系总的物质的量为=(0.02+0.03+0.03)×1=0.08mol;
②K=$\frac{0.03×0.03}{0.02}$=0.045mol/L;
③反应在0~2min区间的平均反应速率v(A)=$\frac{0.03}{2}$=0.015mol/(L•min);
故答案为:①0.08mol;②0.045mol/L;③0.015mol/(L.min).
点评 本题考查了化学反应能量变化,化学平衡影响因素的分析判断,图象分析与化学平衡的计算应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
17.铅蓄电池的总反应式为:PbO2+Pb+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O据此判断下列叙述正确的是( )
| A. | 放电时,H2SO4浓度增加 | |
| B. | 放电时,负极的电极反应式为:Pb+SO42--2e-═PbSO4 | |
| C. | 在充电时,电池中每转移1 mol电子,理论上生成2 mol硫酸 | |
| D. | 在充电时,阴极发生的反应是PbSO4-2e-+2H2O═PbO2+SO42-+4H+ |
18.波立维是国家引进的药,它给中风、心肌梗死等心脏病患者带来福音.波立维属于硫酸氢盐,它的结构如图所示.下列关于它的说法正确的是( )
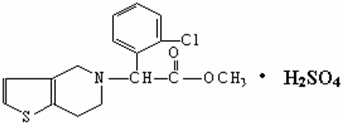

| A. | 该物质的化学式为C16H15ClNO2•H2SO4 | |
| B. | 该物质不溶于水 | |
| C. | 波立维能和氢气反应,每摩最多可消耗3mol氢气 | |
| D. | 它可以与NaOH溶液反应,1mol该物质最多可消耗5molNaOH |
2.下列说法错误的是( )
| A. | 燃烧氧化法可以对有机物进行定性与定量的元素分析 | |
| B. | 提纯液体混合物常用重结晶法 | |
| C. | 红外光谱与核磁共振氢谱可以用于确定有机物的官能团和结构式 | |
| D. | 常用质谱法进行有机物相对分子质量的测定 |
12.中国石油天然气集团在四川发现了中国最大的天然气田,预计储量达7000亿立方米.天然气的主要成分是甲烷,还含有一定量的乙烷、丙烷等可燃性气体.下列有关的说法不正确的是( )
| A. | 甲烷与丙烷互为同系物 | |
| B. | 甲烷不能使高锰酸钾酸性溶液褪色 | |
| C. | 乙烷和氯气在光照的条件下可以发生取代反应 | |
| D. | 甲烷、乙烷、丙烷中的化学键都是极性共价键 |
19.下列反应起了氮的固定作用是( )
| A. | N2和H2在一定条件下反应生成NH3 | |
| B. | NH3经过一系列反应之后生成硝酸盐 | |
| C. | NO与O2反应生成NO2 | |
| D. | 氯化铵受热分解 |
16.下列物质一定属于同系物的是( )
① ②
② ③
③ ④C2H4
④C2H4
⑤CH2═CH-CH═CH2 ⑥C3H6 ⑦ ⑧
⑧
①
 ②
② ③
③ ④C2H4
④C2H4⑤CH2═CH-CH═CH2 ⑥C3H6 ⑦
 ⑧
⑧
| A. | ①和② | B. | ④和⑥ | C. | ④和⑧ | D. | ⑦和⑧ |


 .
.