题目内容
9.设NA代表阿伏加德罗常数,下列说法正确的是( )| A. | 1.5mol单质Fe粉在足量氧气中完全燃烧,失去4NA个电子 | |
| B. | 在25g质量分数为60%的乙酸水溶液中,含有氢原子数为NA | |
| C. | 7.8 gNa2S和Na2O2 的混合物中,含有的阴离子数等于0.15NA | |
| D. | 在5×107Pa、500°C和铁触媒作用下,1molN2和3molH2可生成氨气分子数为2NA |
分析 A.铁在氧气中燃烧生成四氧化三铁;
B.乙酸溶液中乙酸、和水都含有氢原子;
C.过氧化钠中的阴离子为过氧根离子,硫化钠和过氧化钠的摩尔质量都是78g/mol;
D.可逆反应不能进行到底;
解答 解:A.铁在氧气中燃烧生成四氧化三铁,铁在氧气中燃烧生成的是四氧化三铁,铁元素的平均化合价为+$\frac{8}{3}$价,则:1.5mol单质Fe粉在足量氧气中完全燃烧,失去电子$\frac{8}{3}$×$\frac{3}{2}$=4mol,失去4NA个电子,故A正确;
B.乙酸溶液中乙酸、和水都含有氢原子,所以在25g质量分数为60%的乙酸水溶液中,含有氢原子数远远大于NA,故B错误;
C.7.8g Na2S和Na2O2的物质的量为:$\frac{7.8g}{78g/mol}$=0.1mol,过氧化钠中阳离子为过氧根离子,则0.1mol混合物中含有0.1mol阴离子,含有的阴离子数等于0.1NA,故C错误;
D.氮气与氢气反应生成氨气为可逆反应,不能进行到底,所以1molN2和3molH2可生成氨气分子数小于2NA,故D错误;
故选:A.
点评 本题考查阿伏加德罗常数的有关计算和判断,明确标况下气体摩尔体积的使用条件,要求学生掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,注意过氧化钠中阴离子为过氧根离子,题目难度中等.

练习册系列答案
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
19.下列反应起了氮的固定作用是( )
| A. | N2和H2在一定条件下反应生成NH3 | |
| B. | NH3经过一系列反应之后生成硝酸盐 | |
| C. | NO与O2反应生成NO2 | |
| D. | 氯化铵受热分解 |
20.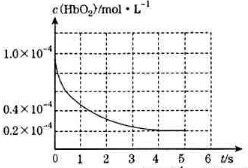 人体吸入CO后在肺部发生反应CO+HbO2?O2+HbCO导致人体缺氧.向某血样中通入CO与O2的混合气[c(CO)=1.0×10-4mol/L,c(O2)=9.9×10-4mol/L]氧合血红蛋白HbO2浓度随时间变化曲线如图所示,下列说法正确的是( )
人体吸入CO后在肺部发生反应CO+HbO2?O2+HbCO导致人体缺氧.向某血样中通入CO与O2的混合气[c(CO)=1.0×10-4mol/L,c(O2)=9.9×10-4mol/L]氧合血红蛋白HbO2浓度随时间变化曲线如图所示,下列说法正确的是( )
 人体吸入CO后在肺部发生反应CO+HbO2?O2+HbCO导致人体缺氧.向某血样中通入CO与O2的混合气[c(CO)=1.0×10-4mol/L,c(O2)=9.9×10-4mol/L]氧合血红蛋白HbO2浓度随时间变化曲线如图所示,下列说法正确的是( )
人体吸入CO后在肺部发生反应CO+HbO2?O2+HbCO导致人体缺氧.向某血样中通入CO与O2的混合气[c(CO)=1.0×10-4mol/L,c(O2)=9.9×10-4mol/L]氧合血红蛋白HbO2浓度随时间变化曲线如图所示,下列说法正确的是( )| A. | 反应开始至4s内用HbO2表示的平均反应速率为2×10-4mol/(L•s) | |
| B. | 反应达平衡之前,O2与HbO2的反应速率逐渐减小 | |
| C. | 将CO中毒病人放入高压氧舱治疗是利用了化学平衡移动原理 | |
| D. | 该温度下反应CO+HbO2?O2+HbCO的平衡常数为107 |
4.下列有关叙述正确的是( )
| A. | CCl4可用于鉴别溴水和碘水 | |
| B. | 甲苯(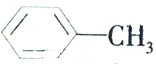 )中所有原子都在同一平面内 )中所有原子都在同一平面内 | |
| C. | 1mol甲苯含有6NA个C-H键 | |
| D. | 苯与甲苯互为同系物,均能使酸性KMnO4溶液褪色 |
10. 现有10种元素的性质、数据如下表所列,它们均为短周期元素.
现有10种元素的性质、数据如下表所列,它们均为短周期元素.
回答下列问题:
(1)D的元素名称是磷,H的元素符号是B.
(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;化合物J2A2的电子式是: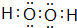 ,构成该物质的化学键类型有极性键和非极性键;画出A与B形成化合物的形成过程表示式:
,构成该物质的化学键类型有极性键和非极性键;画出A与B形成化合物的形成过程表示式: _.
_.
(3)若将标况下E的单质3.36L与通入到100mL 2mol/L的FeBr2溶液中,反应的离子方程式3Cl2+4Fe2++2Br-=6Cl-+4Fe3++Br2
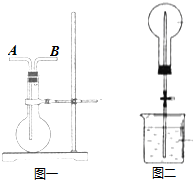
(4)G的氢化物是一种极易溶于水的气体.若用图1所示装置来收集此气体并完成喷泉实验,则气体应从图一的B口进入烧瓶(填字母).烧瓶内收集气体完成后,经测定瓶内气体的密度是相同条件下氢气密度的10.5倍,将此烧瓶按图二完成喷泉实验,请说明引发喷泉的方法用热毛巾将烧瓶捂热,NH3受热膨胀,赶出玻璃导管内的空气和水,NH3与水接触,即发生喷泉.实验完后液体将上升到容器容积的$\frac{2}{3}$.
(5)在Fe(GO3)2溶液中加入稀硫酸,溶液变成了黄色,有关反应的离子方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
(6)甲同学认为I的氧化物IO2与Na2O2反应类似于CO2与Na2O2的反应,该反应的化学方程式是2Na2O2+2SO2=2Na2SO3+O2.乙同学认为也有可能部分IO2被Na2O2氧化了,因此固体产物应该是混合物,为了检验是否有氧化产物生成,他们设计了如下方案:

上述方案是否合理?不合理.请简要说明两点理由:
①若反应后的固体中还残留有Na2O2,则溶于水后,残留的Na2O2会将SO32-氧化为SO42-;
②即使Na2O2已完全反应,加入的稀硝酸也能将BaSO3氧化为BaSO4.
 现有10种元素的性质、数据如下表所列,它们均为短周期元素.
现有10种元素的性质、数据如下表所列,它们均为短周期元素.| A | B | C | D | E | F | G | H | I | J | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 1.02 | 0.037 |
| 最高或最低 化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 | |
| -2 | -3 | -1 | -3 | -2 |
(1)D的元素名称是磷,H的元素符号是B.
(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;化合物J2A2的电子式是:
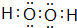 ,构成该物质的化学键类型有极性键和非极性键;画出A与B形成化合物的形成过程表示式:
,构成该物质的化学键类型有极性键和非极性键;画出A与B形成化合物的形成过程表示式: _.
_.(3)若将标况下E的单质3.36L与通入到100mL 2mol/L的FeBr2溶液中,反应的离子方程式3Cl2+4Fe2++2Br-=6Cl-+4Fe3++Br2
(4)G的氢化物是一种极易溶于水的气体.若用图1所示装置来收集此气体并完成喷泉实验,则气体应从图一的B口进入烧瓶(填字母).烧瓶内收集气体完成后,经测定瓶内气体的密度是相同条件下氢气密度的10.5倍,将此烧瓶按图二完成喷泉实验,请说明引发喷泉的方法用热毛巾将烧瓶捂热,NH3受热膨胀,赶出玻璃导管内的空气和水,NH3与水接触,即发生喷泉.实验完后液体将上升到容器容积的$\frac{2}{3}$.
(5)在Fe(GO3)2溶液中加入稀硫酸,溶液变成了黄色,有关反应的离子方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
(6)甲同学认为I的氧化物IO2与Na2O2反应类似于CO2与Na2O2的反应,该反应的化学方程式是2Na2O2+2SO2=2Na2SO3+O2.乙同学认为也有可能部分IO2被Na2O2氧化了,因此固体产物应该是混合物,为了检验是否有氧化产物生成,他们设计了如下方案:

上述方案是否合理?不合理.请简要说明两点理由:
①若反应后的固体中还残留有Na2O2,则溶于水后,残留的Na2O2会将SO32-氧化为SO42-;
②即使Na2O2已完全反应,加入的稀硝酸也能将BaSO3氧化为BaSO4.
7.甲、乙两个研究性学习小组拟从实验室含碘废液中回收碘.制订两种方案提取,他们的实验方案如下:
(甲小组实施的为方案一,乙小组实施的为方案二)
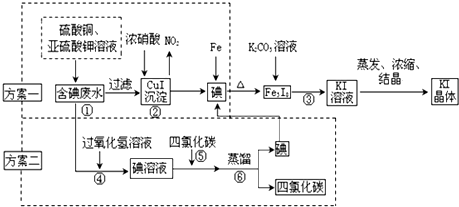
I.CuI在酸性介质中采用FeCl3氧化成即可生成单质碘.请写出上述化学反应方程式2CuI+4Fe3+═4Fe2++2Cu2++I2↓.
Ⅱ.蒸馏时用到的玻璃仪器,除接受器、锥形瓶、酒精灯外,还缺少的玻璃仪器有蒸馏烧瓶、冷凝器、温度计.
Ⅲ.甲小组为测定含碘废水中碘的含量.进行了以下实验操作:
A.各取1000g实验室废水,进行以上操作后,将所得KI晶体溶于适量水中配置成100mL溶液;
B.取KI溶液20mL于锥形瓶中;
C.用稀硫酸酸化所得KI溶液,加入足量KIO3溶液,使KIO3与KI反应完全;
D.以淀粉为指示剂,逐滴加入物质的量浓度为0.3mol•L-1的Na2S2O3溶液20.0mL,恰好反应完全.
已知:I2+2S2O32-=2I-+S4O62-;
(1)请写出步骤 C 中的离子反应方程式.5I-+IO3-+6H+=3I2↓+3H2O
(2)该废液中碘的质量分数为0.32%.
Ⅳ.(1)步骤③中的操作名称为过滤,通过该步操作还得到另一黑色固体物质.
(2)乙小组同学针对该黑色物质的成分,进行了如下步骤进行定性分析:
①在进行步骤四前是否要滴加指示剂?否(填“是”或“否”),请说明理由KMnO4溶液自身可作指示剂.
②通过以上步骤进行分析,该黑色物质可能为Fe3O4.
(甲小组实施的为方案一,乙小组实施的为方案二)

I.CuI在酸性介质中采用FeCl3氧化成即可生成单质碘.请写出上述化学反应方程式2CuI+4Fe3+═4Fe2++2Cu2++I2↓.
Ⅱ.蒸馏时用到的玻璃仪器,除接受器、锥形瓶、酒精灯外,还缺少的玻璃仪器有蒸馏烧瓶、冷凝器、温度计.
Ⅲ.甲小组为测定含碘废水中碘的含量.进行了以下实验操作:
A.各取1000g实验室废水,进行以上操作后,将所得KI晶体溶于适量水中配置成100mL溶液;
B.取KI溶液20mL于锥形瓶中;
C.用稀硫酸酸化所得KI溶液,加入足量KIO3溶液,使KIO3与KI反应完全;
D.以淀粉为指示剂,逐滴加入物质的量浓度为0.3mol•L-1的Na2S2O3溶液20.0mL,恰好反应完全.
已知:I2+2S2O32-=2I-+S4O62-;
(1)请写出步骤 C 中的离子反应方程式.5I-+IO3-+6H+=3I2↓+3H2O
(2)该废液中碘的质量分数为0.32%.
Ⅳ.(1)步骤③中的操作名称为过滤,通过该步操作还得到另一黑色固体物质.
(2)乙小组同学针对该黑色物质的成分,进行了如下步骤进行定性分析:
| 步骤 | 操作 | 现象 |
| 一 | 取黑色物质于烧杯中,加适量水进行洗涤、干燥 | 黑色物质未溶解 |
| 二 | 取适量固体于稀硫酸中进行充分溶解 | 无气体生成 |
| 三 | 移取少量步骤二溶液于试管A中,并滴加硫氰化钾溶液 | 溶液为血红色 |
| 四 | 移取少量步骤二溶液于试管B中,滴加酸性KMnO4溶液 | 酸性KMnO4溶液褪色 |
②通过以上步骤进行分析,该黑色物质可能为Fe3O4.
8.下列化合物中同分异构体数目最少的是( )
| A. | 戊醇 | B. | 戊烷 | ||
| C. | 戊烯 | D. | 戊醛(C5H10O,仅含一个-CHO) |