题目内容
 800K时下列起始体积相同的密闭容器中充入2mol SO2、1mol O2,其反应是2SO2(g)+O2(g)?2SO3(g);△H=-96.56kJ?mol-1,△S=-0.19kJ?mol-1?K-1.甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙容器维持绝热,三容器各自建立化学平衡.已知:△H-T?△S<0时,反应能自发进行.
800K时下列起始体积相同的密闭容器中充入2mol SO2、1mol O2,其反应是2SO2(g)+O2(g)?2SO3(g);△H=-96.56kJ?mol-1,△S=-0.19kJ?mol-1?K-1.甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙容器维持绝热,三容器各自建立化学平衡.已知:△H-T?△S<0时,反应能自发进行.(1)化学平衡常数的表达式K=
(2)正反应在500K时
(3)达到平衡时SO2的转化率α(甲)
考点:化学平衡建立的过程,化学平衡的影响因素
专题:化学平衡专题
分析:(1)依据平衡常数概念书写,利用生成物平衡浓度幂次方乘积除以反应物平衡 浓度幂次方乘积,注意A为固体800℃时,平衡常数不变,甲乙容器温度不变,平衡常数不变,丙容器绝热,温度升高平衡逆向进行,平衡常数减小;
(2)根据反应自发性判断的依据:△H-T△S<0,代入数据进行计算;
(3)达到平衡甲容器在反应过程中保持压强不变,恒温恒压条件压强增大,平衡正向进行,二氧化硫转化率增大,乙容器保持体积不变,丙容器维持绝热反应,温度升高,平衡逆向进行,二氧化硫转化率减小.
(2)根据反应自发性判断的依据:△H-T△S<0,代入数据进行计算;
(3)达到平衡甲容器在反应过程中保持压强不变,恒温恒压条件压强增大,平衡正向进行,二氧化硫转化率增大,乙容器保持体积不变,丙容器维持绝热反应,温度升高,平衡逆向进行,二氧化硫转化率减小.
解答:
解:(1)平衡常数用生成物平衡浓度幂次方乘积除以反应物平衡 浓度幂次方乘积,注意A为固体,K=
;800℃时,平衡常数不变,甲乙容器温度不变,平衡常数不变,丙容器绝热,温度升高平衡逆向进行,平衡常数减小;
故答案为:
;=;>
(2)△H-T△S=-96.56×103J?mol-1-500K×(-0.19kJ?mol-1?K-1)<0,反应能自发;
故答案为:能;
(3)达到平衡时都和乙容器中的二氧化硫浓度比较,依据平衡移动原理,甲容器在反应过程中保持压强不变,恒温恒压条件压强增大,平衡正向进行,二氧化硫转化率增大,乙容器保持体积不变,丙容器维持绝热反应过程,则温度升高平衡逆向进行,二氧化硫转化率减小,
故答案为:>;>.
| c2(SO3) |
| c2(SO2)?c(O2) |
故答案为:
| c2(SO3) |
| c2(SO2)?c(O2) |
(2)△H-T△S=-96.56×103J?mol-1-500K×(-0.19kJ?mol-1?K-1)<0,反应能自发;
故答案为:能;
(3)达到平衡时都和乙容器中的二氧化硫浓度比较,依据平衡移动原理,甲容器在反应过程中保持压强不变,恒温恒压条件压强增大,平衡正向进行,二氧化硫转化率增大,乙容器保持体积不变,丙容器维持绝热反应过程,则温度升高平衡逆向进行,二氧化硫转化率减小,
故答案为:>;>.
点评:本题考查化学反应速率的计算,化学平衡的移动及反应方向的判断

练习册系列答案
相关题目
某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等):
则下列分析推理中不正确的是( )
| Ⅰ | Ⅱ | Ⅲ | |
| 50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
| m(混合物) | 9.2g | 13.8g | 14.2g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
| A、根据表中第Ⅱ组数据不能计算出混合物中NaHCO3的质量分数 |
| B、加入混合物9.2g时盐酸过量 |
| C、盐酸的物质的量浓度为3.0mol?L-1 |
| D、13.8g混合物恰好与盐酸完全反应 |
下列各组结构和性质对比正确的是( )
| A、第一电离能Li<Na |
| B、电负性O<N |
| C、粒子半径F->Mg2+ |
| D、酸性H2SO3>HNO3 |
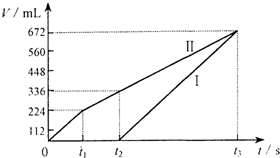 常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图所示(气体体积已换算成标准状况下的体积),根据图中信息(Ⅰ、Ⅱ两极分别代表两极各自产生的气体体积),通过计算推测:
常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图所示(气体体积已换算成标准状况下的体积),根据图中信息(Ⅰ、Ⅱ两极分别代表两极各自产生的气体体积),通过计算推测: 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.