题目内容
12.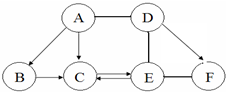 如图 A、B、C、D、E、F为初中化学常见的六种含氧化合物,A、B、C 均由两种元素组成,在常温下状态各不相同,其中A为红色粉末,D、E、F 均由三种元素组成,且物质类别各不相同.“→”表示物质间的转化关系,“-”表示两种物质能相互反应(部分反应物、生成物及反应条件未标出).回答下列问题:
如图 A、B、C、D、E、F为初中化学常见的六种含氧化合物,A、B、C 均由两种元素组成,在常温下状态各不相同,其中A为红色粉末,D、E、F 均由三种元素组成,且物质类别各不相同.“→”表示物质间的转化关系,“-”表示两种物质能相互反应(部分反应物、生成物及反应条件未标出).回答下列问题:(1)C、E的化学式分别为:CH2O、ENaOH.
(2)按化合物组成的差异分类,F属于盐.
(3)A→B的化学方程式为3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(4)化学反应中元素的化合价发生改变的反应叫氧化还原反应,一定不是氧化还原反应的基本反应类型是复分解反应.
分析 A、B、C、D、E、F为初中化学常见的六种含氧化合物,A、B、C 均由两种元素组成,在常温下状态各不相同,其中A为红色粉末,则A为Fe2O3,由A、B、C之间转化可知B为CO2,C为H2O,D、E、F 均由三种元素组成,且物质类别各不相同,D能与氧化铁反应,则D为酸,由相互反应可知,E为碱、F为盐符合转化,则D为硫酸、E为NaOH、F为CuSO4符合转化关系.
解答 解:A、B、C、D、E、F为初中化学常见的六种含氧化合物,A、B、C 均由两种元素组成,在常温下状态各不相同,其中A为红色粉末,则A为Fe2O3,由A、B、C之间转化可知B为CO2,C为H2O,D、E、F 均由三种元素组成,且物质类别各不相同,D能与氧化铁反应,则D为酸,由相互反应可知,E为碱、F为盐符合转化,则D为硫酸、E为NaOH、F为CuSO4符合转化关系.
(1)由上述分析可知,C为H2O、E为NaOH,故答案为:H2O;NaOH;
(2)按化合物组成的差异分类,F属于盐,故答案为:盐;
(3)A→B的化学方程式为:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,故答案为:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(4)化学反应中元素的化合价发生改变的反应叫氧化还原反应,一定不是氧化还原反应的基本反应类型是:复分解反应,故答案为:复分解反应.
点评 本题考查无机物推断,注意为初中常见物质,属于猜测验证型题目,需要学生熟练掌握元素化合物知识,难度不大.

练习册系列答案
相关题目
2.MnO2在酸性溶液中具有强氧化性,可被还原为Mn2+,它还对H2O2的分解具有良好的催化效果.某兴趣小组通过实验研究MnO2的性质.
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是A.
A、把MnO2固体加入到FeSO4溶液中,再加入KSCN溶液,观察溶液是否变红
B、把MnO2固体加入到FeCl3溶液中,再加入KSCN溶液,观察溶液是否变红
C、把MnO2固体加入到Na2SO3溶液中,再加入BaCl2观察是否有白色沉淀生成
D、把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
(2)该小组为研究在不同酸碱性的溶液中MnO2的氧化能力,他们控制KI溶液的浓度和MnO2固体的质量相同,恒定实验温度在298K,设计如下对比试验.该小组从上述对比实验中,可以得出的结论是酸性越强,MnO2氧化性越强.
写出在酸性条件下,MnO2氧化I-的离子方程式2I-+MnO2+4H+═I2+Mn2++2H2O.
(3)欲探究MnO2的催化效果,需要用30%的H2O2溶液(密度近似为1g/cm3)配制浓度3%的H2O2溶液(密度近似为1g/cm3)100mL.其配制方法是:用量筒量取10.0mL30%H2O2溶液放入烧杯(填仪器名称)中,再加入一定量的水,搅拌均匀.
(4)在实验时,某同学把1滴KI溶液误滴入到过量的5mL3%的H2O2溶液中,发现产生了大量气泡.该小组查阅到KI与H2O2可发生如下反应:2KI+H2O2=KOH+I2,认为有可能是反应产物I2起了催化H2O2分解的作用.请设计一个简单实验证明该假设是否正确.取5mL3%的H2O2溶液于试管中,滴入1滴碘水,观察是否有大量气泡产生,若有说明假设正确;反之假设不正确.
(5)实验室用二氧化锰和浓盐酸制取氯气,下列仪器可作为该反应的反应容器的是AD(填序号).

(6)二氧化锰可用于制作干电池,电池总反应为:Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3+H2O,则其正极的电极反应式为2MnO2+2NH4++2e-=Mn2O3+2NH3+H2O.
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是A.
A、把MnO2固体加入到FeSO4溶液中,再加入KSCN溶液,观察溶液是否变红
B、把MnO2固体加入到FeCl3溶液中,再加入KSCN溶液,观察溶液是否变红
C、把MnO2固体加入到Na2SO3溶液中,再加入BaCl2观察是否有白色沉淀生成
D、把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
(2)该小组为研究在不同酸碱性的溶液中MnO2的氧化能力,他们控制KI溶液的浓度和MnO2固体的质量相同,恒定实验温度在298K,设计如下对比试验.该小组从上述对比实验中,可以得出的结论是酸性越强,MnO2氧化性越强.
写出在酸性条件下,MnO2氧化I-的离子方程式2I-+MnO2+4H+═I2+Mn2++2H2O.
| 实验 | 酸或碱 | 现象 |
| A | 1滴0.2mol/LNaOH溶液 | 不变色 |
| B | 1滴水 | 缓慢变浅棕褐色 |
| C | 1滴0.1mol/L硫酸溶液 | 迅速变棕褐色 |
(4)在实验时,某同学把1滴KI溶液误滴入到过量的5mL3%的H2O2溶液中,发现产生了大量气泡.该小组查阅到KI与H2O2可发生如下反应:2KI+H2O2=KOH+I2,认为有可能是反应产物I2起了催化H2O2分解的作用.请设计一个简单实验证明该假设是否正确.取5mL3%的H2O2溶液于试管中,滴入1滴碘水,观察是否有大量气泡产生,若有说明假设正确;反之假设不正确.
(5)实验室用二氧化锰和浓盐酸制取氯气,下列仪器可作为该反应的反应容器的是AD(填序号).

(6)二氧化锰可用于制作干电池,电池总反应为:Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3+H2O,则其正极的电极反应式为2MnO2+2NH4++2e-=Mn2O3+2NH3+H2O.
3.下列实验操作中,仪器一定需要插入液面以下的
①制备Fe(OH)2时将NaOH溶液滴入FeSO4溶液中所用的胶头滴管
②制备氢气的简易装置中的长颈漏斗
③分馏石油时控制温度所用的温度计
④用乙醇制备乙烯时所用的温度计
⑤向BaCl2溶液中滴加稀硫酸所用的胶头滴管( )
①制备Fe(OH)2时将NaOH溶液滴入FeSO4溶液中所用的胶头滴管
②制备氢气的简易装置中的长颈漏斗
③分馏石油时控制温度所用的温度计
④用乙醇制备乙烯时所用的温度计
⑤向BaCl2溶液中滴加稀硫酸所用的胶头滴管( )
| A. | ③⑤ | B. | ②⑤ | C. | ①②④ | D. | ①②③④⑤ |
20.在锌片和盐酸的反应中,加入如下试剂,可使生成氢气的速度变慢的是( )
| A. | 硫酸铜晶体 | B. | HCl气体 | C. | 氯化钡晶体 | D. | 醋酸钾晶体 |
17.Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量为2:1时,实际参加反应的Cu2S与HNO3的物质的量之比为( )
| A. | 1:7 | B. | 1:5 | C. | 1:8 | D. | 2:9 |
4.根据反应(1)~(4),可以判断下列4个物质的氧化性由强到弱的正确顺序是( )
(1)Cl2+2KI=2KCl+I2
(2)2FeCl2+Cl2=2FeCl3
(3)2FeCl3+2HI=2FeCl2+2HCl+I2
(4)H2S+I2=S+2HI.
(1)Cl2+2KI=2KCl+I2
(2)2FeCl2+Cl2=2FeCl3
(3)2FeCl3+2HI=2FeCl2+2HCl+I2
(4)H2S+I2=S+2HI.
| A. | H2S>I2>Fe3+>Cl2 | B. | Cl2>Fe3+>I2>H2S | ||
| C. | Fe3+>Cl2>H2S>I2. | D. | Cl2>I2>Fe3+>H2S |
1.若NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1mol CH3+(碳正离子)中含有质子数为8NA | |
| B. | 6.4gCu与足量的硫反应,转移电子数为0.2 NA | |
| C. | 标准状况下,将分子总数为NA的NH3和HCl的充分混合后,所得混合气体体积越为22.4L | |
| D. | 7.8g Na2O2中含有的离子总数目为0.3NA |