题目内容
1.若NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 1mol CH3+(碳正离子)中含有质子数为8NA | |
| B. | 6.4gCu与足量的硫反应,转移电子数为0.2 NA | |
| C. | 标准状况下,将分子总数为NA的NH3和HCl的充分混合后,所得混合气体体积越为22.4L | |
| D. | 7.8g Na2O2中含有的离子总数目为0.3NA |
分析 A、碳正离子中含9个质子;
B、求出铜的物质的量,然后根据铜和硫反应后变为+1价来分析;
C、NH3和HCl混合后会生成氯化铵;
D、求出过氧化钠的物质的量,然后根据1mol过氧化钠中含2mol钠离子和1mol过氧根来分析.
解答 解:A、碳正离子中含9个质子,故1mol碳正离子中含9mol质子即9NA个,故A错误;
B、6.4g铜的物质的量为0.1mol,由于铜和硫反应后变为+1价,故0.1mol铜反应后失去0.1mol电子即0.1NA个,故B错误;
C、NH3和HCl混合后会生成氯化铵固体,在标况下的体积小于22.4L,故C错误;
D、7.8g过氧化钠的物质的量为0.1mol,而1mol过氧化钠中含2mol钠离子和1mol过氧根,故0.1mol过氧化钠中含0.3mol离子即0.3NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
11.生活中的一些问题常涉及到化学知识,则下列叙述正确的是( )
| A. | 氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5微粒均具有丁达尔效应 | |
| B. | 明矾和漂白粉常用于自来水的处理,两者的作用原理相同 | |
| C. | 氯化铁溶液可用于制作印刷电路板是因为其具有较强氧化性,与铜发生置换反应 | |
| D. | 高温能杀死流感病毒是因为构成病毒的蛋白质受热变性 |
16.下列化学用语正确的是( )
| A. | 14C原子的结构示意图: | |
| B. | H2O2的电子式: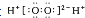 | |
| C. | NH4C的电子式: | |
| D. | 原子核内有10个中子的氧原子${\;}_{8}^{16}$O |
6.根据下表所示化学反应与数据关系:
请回答:
(1)反应①是吸热(填“吸热”或“放热”)反应.
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=$\frac{{K}_{2}}{{K}_{1}}$(用K1、K2表示).
(3)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有CE(填写字母序号).
A、缩小反应容器的容积 B、扩大反应容器的容积 C、升高温度
D、使用合适的催化剂 E、设法减小平衡体系中的CO的浓度
(4)若反应③的逆反应速率与时间的关系如图所示:
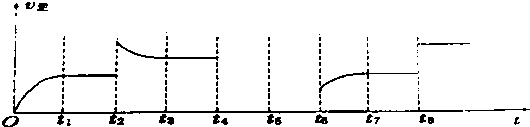
①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时增大生成物浓度或升高温度,t8时加入催化剂或加压.
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线.
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ③CO(g)+H2O(g)?CO2(g)+H2(g) | K3 | ? | ? |
(1)反应①是吸热(填“吸热”或“放热”)反应.
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=$\frac{{K}_{2}}{{K}_{1}}$(用K1、K2表示).
(3)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有CE(填写字母序号).
A、缩小反应容器的容积 B、扩大反应容器的容积 C、升高温度
D、使用合适的催化剂 E、设法减小平衡体系中的CO的浓度
(4)若反应③的逆反应速率与时间的关系如图所示:

①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时增大生成物浓度或升高温度,t8时加入催化剂或加压.
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线.
13.世界气候变化哥本哈根会议讨论了导致全球气候变暖的主要物质是下列中的( )
| A. | N2 | B. | O2 | C. | CO2 | D. | SO2 |
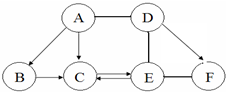 如图 A、B、C、D、E、F为初中化学常见的六种含氧化合物,A、B、C 均由两种元素组成,在常温下状态各不相同,其中A为红色粉末,D、E、F 均由三种元素组成,且物质类别各不相同.“→”表示物质间的转化关系,“-”表示两种物质能相互反应(部分反应物、生成物及反应条件未标出).回答下列问题:
如图 A、B、C、D、E、F为初中化学常见的六种含氧化合物,A、B、C 均由两种元素组成,在常温下状态各不相同,其中A为红色粉末,D、E、F 均由三种元素组成,且物质类别各不相同.“→”表示物质间的转化关系,“-”表示两种物质能相互反应(部分反应物、生成物及反应条件未标出).回答下列问题: 发生在天津港“8•12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注.
发生在天津港“8•12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注.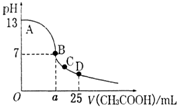 室温下,在25mL 0.1mol.L-1NaOH溶液中逐滴加入0.2mol•L-1 CH3COOH 溶液,pH 与滴加 CH3COOH溶液体积的关系曲线如图所示,若忽略两溶液混合时的体积变化,下列有关粒子浓度关系的说法错误的是( )
室温下,在25mL 0.1mol.L-1NaOH溶液中逐滴加入0.2mol•L-1 CH3COOH 溶液,pH 与滴加 CH3COOH溶液体积的关系曲线如图所示,若忽略两溶液混合时的体积变化,下列有关粒子浓度关系的说法错误的是( )