题目内容
4.根据反应(1)~(4),可以判断下列4个物质的氧化性由强到弱的正确顺序是( )(1)Cl2+2KI=2KCl+I2
(2)2FeCl2+Cl2=2FeCl3
(3)2FeCl3+2HI=2FeCl2+2HCl+I2
(4)H2S+I2=S+2HI.
| A. | H2S>I2>Fe3+>Cl2 | B. | Cl2>Fe3+>I2>H2S | ||
| C. | Fe3+>Cl2>H2S>I2. | D. | Cl2>I2>Fe3+>H2S |
分析 同一化学反应中,氧化剂的氧化性大于氧化产物的氧化性,根据元素化合价的变化判断氧化剂和氧化产物,据此分析解答.
解答 解:(1)Cl2+2KI=2KCl+I2 反应中Cl2做氧化剂,氧化KI得到氧化产物I2,氧化性:Cl2>I2;
(2)2FeCl2+Cl2=2FeCl3反应中Cl2做氧化剂,氧化FeCl2得到氧化产物FeCl3,氧化性:Cl2>FeCl3;
(3)2FeCl3+2HI=2FeCl2+2HCl+I2 反应中FeCl3做氧化剂,氧化HI得到氧化产物I2,氧化性:FeCl3>I2;
(4)H2S+I2=2HI+S反应中I2做氧化剂,氧化H2S得到氧化产物S,氧化性:I2>S;
则氧化性顺序为:Cl2>FeCl3>I2>S,
故选B.
点评 本题考查了根据方程式来比较氧化性和还原性,解题的关键是根据化合价找出氧化剂、还原剂、氧化产物和还原产物,题目难度不大.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
15.下列物质属于碱的是( )
| A. | 纯碱 | B. | 碱式碳酸铜 | C. | 漂白粉 | D. | 烧碱 |
16.下列化学用语正确的是( )
| A. | 14C原子的结构示意图: | |
| B. | H2O2的电子式: | |
| C. | NH4C的电子式: | |
| D. | 原子核内有10个中子的氧原子${\;}_{8}^{16}$O |
13.世界气候变化哥本哈根会议讨论了导致全球气候变暖的主要物质是下列中的( )
| A. | N2 | B. | O2 | C. | CO2 | D. | SO2 |
14.某同学采用硫铁矿焙烧取硫后的烧渣 制取七水合硫酸亚铁,设计了如图流程:
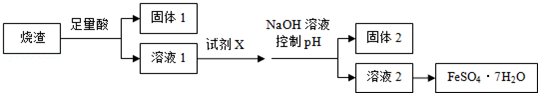
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 溶解烧渣选用足量硫酸,试剂X选用铁粉 | |
| B. | 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al3,进入固体2 | |
| C. | 从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化和分解 | |
| D. | 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4•7H2O |
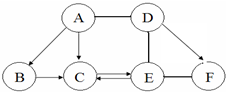 如图 A、B、C、D、E、F为初中化学常见的六种含氧化合物,A、B、C 均由两种元素组成,在常温下状态各不相同,其中A为红色粉末,D、E、F 均由三种元素组成,且物质类别各不相同.“→”表示物质间的转化关系,“-”表示两种物质能相互反应(部分反应物、生成物及反应条件未标出).回答下列问题:
如图 A、B、C、D、E、F为初中化学常见的六种含氧化合物,A、B、C 均由两种元素组成,在常温下状态各不相同,其中A为红色粉末,D、E、F 均由三种元素组成,且物质类别各不相同.“→”表示物质间的转化关系,“-”表示两种物质能相互反应(部分反应物、生成物及反应条件未标出).回答下列问题: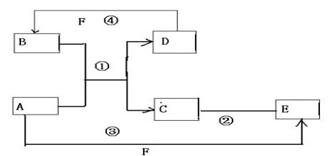
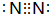 反应?①的化学方程式2NH3+3Cl2=N2+6HCl
反应?①的化学方程式2NH3+3Cl2=N2+6HCl 发生在天津港“8•12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注.
发生在天津港“8•12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注.