题目内容
17.Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量为2:1时,实际参加反应的Cu2S与HNO3的物质的量之比为( )| A. | 1:7 | B. | 1:5 | C. | 1:8 | D. | 2:9 |
分析 Cu2S与一定浓度的HNO3反应中,Cu2S中铜元素由+1价被氧化为+2价、硫元素由-2价被氧化为+6价,硝酸起氧化剂与酸的作用,起氧化剂作用HNO3中氮元素被还原为NO2和NO,起酸作用的硝酸生成Cu(NO3)2.令NO2和NO的物质的量分别为2mol、1mol,根据电子转移守恒计算参加反应的Cu2S的物质的量,由氮元素守恒可知参加反应的硝酸n(HNO3)=2n[Cu(NO3)2]+n(NO2)+n(NO),根据铜元素守恒可知溶液中n[Cu(NO3)2]=2n(Cu2S)-n(CuSO4),由硫元素守恒可知n(Cu2S)=n(CuSO4),据此计算参加反应的硝酸的物质的量,以此解答该题.
解答 解:Cu2S与一定浓度的HNO3反应中,Cu2S中铜元素由+1价被氧化为+2价、硫元素由-2价被氧化为+6价,硝酸起氧化剂与酸的作用,起氧化剂作用HNO3中氮元素被还原为NO2和NO,起酸作用的硝酸生成Cu(NO3)2.
令NO2和NO的物质的量分别为2mol、1mol,根据电子转移守恒可知:
n(Cu2S)×[6-(-2)+1×2]=2mol×(5-4)+1mol×(5-2),解得n(Cu2S)=0.5mol,
由硫元素守恒可知n(CuSO4)=n(Cu2S)=0.5mol,
根据铜元素守恒可知溶液中n[Cu(NO3)2]=2n(Cu2S)-n(CuSO4)=2×0.5mol-0.5mol=0.5mol,
由氮元素守恒可知参加反应的硝酸n(HNO3)=2n[Cu(NO3)2]+n(NO2)+n(NO)=2×0.5mol+2mol+1mol=4mol,
所以实际参加反应的Cu2S与HNO3的物质的量之比为n(Cu2S):n(HNO3)=0.5mol:4mol=1:8,
故选C.
点评 本题考查化学方程式的有关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,利用电子转移守恒与元素守恒计算是关键,转移守恒思想在氧化还原反应计算中的运用,难度不大.

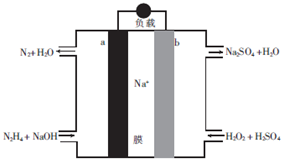
| A. | a极为电池的正极 | |
| B. | 电路中每转移6.02×1023个电子,则有1molNa+穿过膜向正极移动 | |
| C. | b极的电极反应式为H2O2+2e-=2OH- | |
| D. | 用该电池电解饱和食盐水,当阳极生成2.24L(标准状况)Cl2时,消耗肼0.1mol |
 某容器中发生一个化学反应,反应过程存在H2O、ClO-、CN-、HCO3-、N2、Cl-6种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
某容器中发生一个化学反应,反应过程存在H2O、ClO-、CN-、HCO3-、N2、Cl-6种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )| A. | 当有3 mol ClO-参加反应时,则有1 mol N2生成 | |
| B. | HCO3-作为碱性介质参与反应 | |
| C. | 当有5 mol ClO-参加反应时,则有1 mol N2生成 | |
| D. | 若生成2.24 L N2,则转移电子0.6 mol |

| A. | ①②③④⑤ | B. | ①②⑤ | C. | ①②③④ | D. | ②④⑤ |
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ③CO(g)+H2O(g)?CO2(g)+H2(g) | K3 | ? | ? |
(1)反应①是吸热(填“吸热”或“放热”)反应.
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=$\frac{{K}_{2}}{{K}_{1}}$(用K1、K2表示).
(3)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有CE(填写字母序号).
A、缩小反应容器的容积 B、扩大反应容器的容积 C、升高温度
D、使用合适的催化剂 E、设法减小平衡体系中的CO的浓度
(4)若反应③的逆反应速率与时间的关系如图所示:
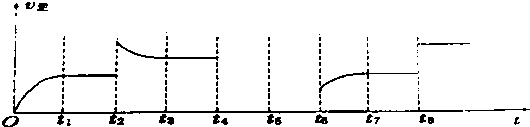
①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时增大生成物浓度或升高温度,t8时加入催化剂或加压.
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线.
 B.
B. C.
C. .
.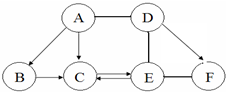 如图 A、B、C、D、E、F为初中化学常见的六种含氧化合物,A、B、C 均由两种元素组成,在常温下状态各不相同,其中A为红色粉末,D、E、F 均由三种元素组成,且物质类别各不相同.“→”表示物质间的转化关系,“-”表示两种物质能相互反应(部分反应物、生成物及反应条件未标出).回答下列问题:
如图 A、B、C、D、E、F为初中化学常见的六种含氧化合物,A、B、C 均由两种元素组成,在常温下状态各不相同,其中A为红色粉末,D、E、F 均由三种元素组成,且物质类别各不相同.“→”表示物质间的转化关系,“-”表示两种物质能相互反应(部分反应物、生成物及反应条件未标出).回答下列问题: 发生在天津港“8•12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注.
发生在天津港“8•12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注. 已知A、B、D、E均为中学化学常见物质,它们之间的转化关系如图所示(部分产物略去,①②③④的反应条件均相同).则A、E可能的组合为( )
已知A、B、D、E均为中学化学常见物质,它们之间的转化关系如图所示(部分产物略去,①②③④的反应条件均相同).则A、E可能的组合为( )