题目内容
12.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )| A. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)十c(OH-) | |
| B. | 0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)═c(Na+)+c(H+) | |
| D. | 0.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合:$\frac{2}{3}$c(Na+)═c(CO32-)+c(HCO3-)+c(H2CO3) |
分析 A.pH=1的NaHSO4溶液中电荷守恒,c(Na+)=c(SO42-),计算分析;
B.0.1mol/LNH4Cl与0.1mol/L氨水等体积混合,溶液pH>7,一水合氨电离程度大于铵根离子水解程度:
C.0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合生成NaCl、NaHC2O4,溶液中存在电荷守恒分析;
D..1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合,溶液中存在物料守恒2n(Na)=3n(C),碳元素所有存在形式总和和所有钠离子至今存在守恒关系.
解答 解:A.pH=1的NaHSO4溶液中电荷守恒,c(H+)+c(Na+)=2c(SO42-)十c(OH-),c(Na+)=c(SO42-),计算得到(H+)=c(SO42-)十c(OH-),故A正确;
B.0.1mol/LNH4Cl与0.1mol/L氨水等体积混合,溶液pH>7,一水合氨电离程度大于铵根离子水解程度,c(NH4+)>c(NH3•H2O)>c(Cl-)>c(OH-),故B错误:
C.0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合生成NaCl、NaHC2O4,溶液中存在电荷守恒,c(Cl-)+2c(C2O42-)+c(HC2O4-)+c(OH-)═c(Na+)+c(H+),故C错误;
D.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合,溶液中存在物料守恒2n(Na)=3n(C),碳元素所有存在形式总和和所有钠离子至今存在守恒关系,2c(Na+)═3c(CO32-)+3c(HCO3-)+3c(H2CO3),$\frac{2}{3}$c(Na+)═c(CO32-)+c(HCO3-)+c(H2CO3),故D正确;
故选AD.
点评 本题考查了电解质溶液中离子浓度大小比较、电荷守恒、物料守恒、弱电解质电离平衡等知识点,掌握基础是解题关键,题目难度中等.

 一本好题口算题卡系列答案
一本好题口算题卡系列答案| A. | 1:1:1 | B. | 3:2:1 | C. | 3:2:3 | D. | 1:1:3 |
 已知草酸为二元弱酸:H2C2O4═HC2O4-+H+Ka 1; HC2O4-═C2O42-+H +Ka 2常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42- 三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是( )
已知草酸为二元弱酸:H2C2O4═HC2O4-+H+Ka 1; HC2O4-═C2O42-+H +Ka 2常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42- 三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是( )| A. | 常温下,Ka 1:Ka 2=1000 | |
| B. | 将相同物质的量 KHC2O4 和 K2C2O4固体完全溶于水可配得 pH 为 4.2 的混合液 | |
| C. | pH=1.2 溶液中:c(K +)+c(H + )=c(OH-)+c(H2C2O4) | |
| D. | 向 pH=1.2 的溶液中加 KOH 溶液将pH增大至4.2的过程中水的电离度一直增大 |
| A. | 向NaHCO3溶液中通CO2至pH=7:c(Na+)═c(HCO3-)+c(CO32-) | |
| B. | 向CH3COONa溶液中加入等浓度等体积的盐酸:c(Na+)>c(Cl-) | |
| C. | 向浓度为0.1mol/LNaHSO4溶液中加入等浓度等体积的Ba(OH)2溶液:pH<13 | |
| D. | 将0.1molAgCl投入到100mL0.1mol/LNaCl溶液中:c(Ag+)=c(Cl-) |
| A. | pH相同的①CH3COONa、②NaHCO3两种溶液中的c(Na+):②>① | |
| B. | 0.1mol•L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A) | |
| C. | 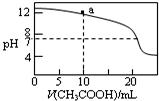 图表示用0.1 mol/L CH3COOH溶液滴定20 mL 0.1mol/L NaOH溶液的滴定曲线,则pH=7时:c(Na+)>c(CH3COO-)>c(OH-)=c(H+) | |
| D. | 上图a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
| A. | 原子半径:X>Y>Z>W | |
| B. | W的含氧酸的酸性比Z的含氧酸的酸性强 | |
| C. | W的气态氢化物的稳定性小于Y的气态氢化物的稳定性 | |
| D. | 若W与X原子序数差为5,则形成化合物的化学式为X3W2 |
| A. | Li、Be、B原子最外层电子数依次增多 | |
| B. | P、S、Cl元素最高正价依次升高 | |
| C. | N、O、F原子半径依次增大 | |
| D. | Li、Na、K、Rb单质的密度依次增大 |