题目内容
3.今有0.3mol/L K2SO4溶液200mL,0.2mol/L MgSO4溶液300mL和0.1mol/L Al2(SO4)3溶液200mL,这三种溶液中硫酸根离子浓度之比是( )| A. | 1:1:1 | B. | 3:2:1 | C. | 3:2:3 | D. | 1:1:3 |
分析 硫酸根离子的浓度与各溶液体积大小无关,与溶质的物质的量浓度及溶质化学式组成有关,据此计算出三种溶液中硫酸根离子浓度之比.
解答 解:0.3mol/L K2SO4溶液200mL,含有硫酸根离子浓度为0.3mol/L;
0.2mol/L MgSO4溶液300mL,含有硫酸根离子浓度为0.2mol/L;
0.1mol/L Al2(SO4)3溶液200mL,含有硫酸根离子浓度为:0.1mol/L×3=0.3mol/L,
所以三种溶液中硫酸根离子浓度之比为:0.3mol/L:0.2mol/L:0.3mol/L=3:2:3,
故选C.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式为解答关键,注意离子的浓度与溶液体积大小无关,为易错点,试题培养了学生的化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.关于铭${\;}_{18}^{40}Ar$的说法正确的是( )
| A. | 质子数为18 | B. | 中子数为40 | C. | 质量数为58 | D. | 核外电子数为22 |
11.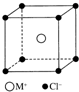 MCl晶体具有立方体结构,其晶胞结构如图所示,在该晶体中,每个M+周围与它最接近的且距离相等的M+的个数共有( )
MCl晶体具有立方体结构,其晶胞结构如图所示,在该晶体中,每个M+周围与它最接近的且距离相等的M+的个数共有( )
 MCl晶体具有立方体结构,其晶胞结构如图所示,在该晶体中,每个M+周围与它最接近的且距离相等的M+的个数共有( )
MCl晶体具有立方体结构,其晶胞结构如图所示,在该晶体中,每个M+周围与它最接近的且距离相等的M+的个数共有( )| A. | 6个 | B. | 8个 | C. | 12个 | D. | 16个 |
18.在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A. | H+、Fe3+、I-、NO3- | B. | Na+、Ba2+、Cl-、NO3- | ||
| C. | Na+、K+、HCO3-、OH- | D. | K+、NH4+、OH-、SO42- |
12.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)十c(OH-) | |
| B. | 0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)═c(Na+)+c(H+) | |
| D. | 0.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合:$\frac{2}{3}$c(Na+)═c(CO32-)+c(HCO3-)+c(H2CO3) |

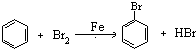 (或
(或 ).
). W、X、Y、Z为元素周期表中前四周期原子序数依次增大的元素.W的基态原子中占据哑铃形原子轨道的电子数为3,X2+与W3-具有相同的电子层结构;W与X的最外层电子数之和等于Y的最外层电子数;Z元素位于元素周期表的第6列.
W、X、Y、Z为元素周期表中前四周期原子序数依次增大的元素.W的基态原子中占据哑铃形原子轨道的电子数为3,X2+与W3-具有相同的电子层结构;W与X的最外层电子数之和等于Y的最外层电子数;Z元素位于元素周期表的第6列.
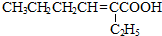 所需试剂为银氨溶液,酸.
所需试剂为银氨溶液,酸.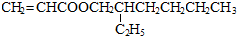
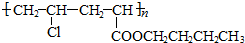
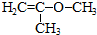 等
等