题目内容
7.室温下进行相关实验.下列结论正确的是( )| A. | 向NaHCO3溶液中通CO2至pH=7:c(Na+)═c(HCO3-)+c(CO32-) | |
| B. | 向CH3COONa溶液中加入等浓度等体积的盐酸:c(Na+)>c(Cl-) | |
| C. | 向浓度为0.1mol/LNaHSO4溶液中加入等浓度等体积的Ba(OH)2溶液:pH<13 | |
| D. | 将0.1molAgCl投入到100mL0.1mol/LNaCl溶液中:c(Ag+)=c(Cl-) |
分析 A.依据溶液中电荷守恒分析判断离子浓度关系;
B.向CH3COONa溶液中加入等浓度等体积的盐酸发生反应生成氯化钠和醋酸;钠离子浓度和氯离子浓度相同;
C.向浓度为0.1mol/LNaHSO4溶液中加入等浓度等体积的Ba(OH)2溶液发生反应生成硫酸钡沉淀、水和氢氧化钠;
D.氯化银投入氯化钠溶液中,氯离子抑制溶解,沉淀溶解平衡逆向进行.
解答 解:A.依据溶液中电荷守恒分析判断离子浓度,向NaHCO3溶液中通CO2至pH=7,c(H+)=c(OH-):c(Na+)+c(H+)═c(HCO3-)+2c(CO32-)+c(OH-),则c(Na+)═c(HCO3-)+2c(CO32-),故A错误;
B.向CH3COONa溶液中加入等浓度等体积的盐酸发生反应生成氯化钠和醋酸;钠离子浓度和氯离子浓度相同,c(Na+)=c(Cl-),故B错误;
C.向浓度为0.1mol/LNaHSO4溶液中加入等浓度等体积的Ba(OH)2溶液发生反应生成硫酸钡沉淀、水和氢氧化钠溶液,NaHSO4+Ba(OH)2=BsSO4↓+H2O+NaOH,溶液中氢氧根离子浓度=$\frac{0.1×1}{2}$=0.05mol/L,c(H+)=$\frac{1{0}^{-14}}{0.05}$=2×10-13mol/L,溶液PH=13-lg2,pH<13,故C正确;
D.氯化银投入氯化钠溶液中,氯离子抑制溶解,AgCl(g)?Ag+(aq)+Cl-(aq),沉淀溶解平衡逆向进行,c(Ag+)<c(Cl-),故D错误;
故选C.
点评 本题考查了电解质溶液中电荷守恒、离子浓度大小比较、沉淀溶解平衡等知识点,掌握基础是解题关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.与27.0克H2O含有相同中子数的D2O质量为( )
| A. | 13.2g | B. | 20.1g | C. | 24.0g | D. | 30.0g |
18.在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A. | H+、Fe3+、I-、NO3- | B. | Na+、Ba2+、Cl-、NO3- | ||
| C. | Na+、K+、HCO3-、OH- | D. | K+、NH4+、OH-、SO42- |
2.常温常压下,某烧碱溶液与0.05mol氯气恰好完全反应,得到pH=9的混合溶液(溶质为NaCl与NaClO).下列说法正确的是(NA代表阿伏伽德罗常数)( )
| A. | 氯气的体积为1.12 L | |
| B. | 原烧碱溶液中含溶质离子0.2NA个 | |
| C. | 所得溶液中含OH-的数目为1×10-5NA | |
| D. | 所得溶液中ClO-的数目为0.05NA |
12.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)十c(OH-) | |
| B. | 0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)═c(Na+)+c(H+) | |
| D. | 0.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合:$\frac{2}{3}$c(Na+)═c(CO32-)+c(HCO3-)+c(H2CO3) |
19.下列说法正确的是( )
| A. | 基态时,相同周期的两种元素原子所含的能级和能层是一样的 | |
| B. | 基态时,稀有气体元素原子的价层电子数都为8 | |
| C. | 基态时,同种元素的原子和离子的轨道排布式一样 | |
| D. | 非金属元素原子的d轨道一定不填充电子或填满电子 |
16.有关糖类叙述正确的是( )
| A. | 糖类是有甜的有机物 | |
| B. | 糖类物质又叫碳水化合物,因此所有的糖类均可用通式Cn(H2O)m来表示 | |
| C. | 糖类物质和碳水化合物没有实质的联系 | |
| D. | 糖类可以分为单糖和多糖 |
20.化学无处不在,下列说法错误的是( )
| A. | 青蒿素(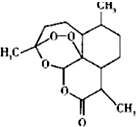 )可能具有氧化性 )可能具有氧化性 | |
| B. | “.煤改气”、“煤改电”等有利于减少雾霾天气 | |
| C. | 侯氏制碱法中,向饱和NaCI溶液中先通人NH3,再通人CO2 | |
| D. | 洁厕剂(含HCI )和漂白粉混合使用可使去污效果更好 |
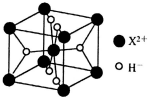 W、X、Y、Z为元素周期表中前四周期原子序数依次增大的元素.W的基态原子中占据哑铃形原子轨道的电子数为3,X2+与W3-具有相同的电子层结构;W与X的最外层电子数之和等于Y的最外层电子数;Z元素位于元素周期表的第6列.
W、X、Y、Z为元素周期表中前四周期原子序数依次增大的元素.W的基态原子中占据哑铃形原子轨道的电子数为3,X2+与W3-具有相同的电子层结构;W与X的最外层电子数之和等于Y的最外层电子数;Z元素位于元素周期表的第6列.