题目内容
14.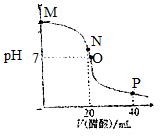 常温下,向20.0mL 0.10mol•L-1的NaOH溶液中逐滴加入0.10mol•L-1的醋酸溶液,溶液pH随醋酸溶液体积的变化如图所示.下列说法正确的是( )
常温下,向20.0mL 0.10mol•L-1的NaOH溶液中逐滴加入0.10mol•L-1的醋酸溶液,溶液pH随醋酸溶液体积的变化如图所示.下列说法正确的是( )| A. | N点处恰好完全反应,c(CH3COO-)=c(CH3COOH) | |
| B. | O点处显中性,c(CH3COO-)=c(Na+)=c(H+)=c(OH-) | |
| C. | M点到O点过程中,可能出现c(CH3COO-)>c(Na+) | |
| D. | P点处显酸性,c(CH3COO-)+c(CH3COOH)=2c(Na+) |
分析 A、N点处也就是两者等体积,恰好完全反应,生成醋酸钠;
B、O点溶液PH=7,溶液呈中性;
C、M点到O点过程中,溶液呈碱性,所以c(H+)<c(OH-),根据电荷守恒:c(CH3COO-)<c(Na+);
D、P点是醋酸和醋酸钠的混合溶液,醋酸的电离导致溶液呈酸性,根据物料守恒分析解答.
解答 解:A、N点处也就是两者等体积,恰好完全反应,生成醋酸钠,醋酸根离子的水解微弱,所以c(CH3COO-)>c(CH3COOH),故A错误;
B、O点溶液PH=7,溶液呈中性,所以c(CH3COO-)=c(Na+)>c(H+)=c(OH-),故B错误;
C、M点到O点过程中,溶液呈碱性,所以c(H+)<c(OH-),根据电荷守恒:c(CH3COO-)<c(Na+),所以不可能出现c(CH3COO-)>c(Na+),故C错误;
D、P点是醋酸和醋酸钠的混合溶液,醋酸的电离导致溶液呈酸性,根据物料守恒c(CH3COO-)+c(CH3COOH)=2c(Na+),故D正确;
故选D.
点评 本题考查酸碱混合溶液中离子浓度大小的比较,明确酸碱混合后溶液中的溶质及量的关系是解答本题的关键,并利用电离、水解、电荷守恒、物料守恒等知识来解答,题目难度中等.

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
4.下列有关实验操作及其结论正确的是( )
| A. | 加入过量氨水,有白色沉淀生成,则原溶液中一定有Al3+ | |
| B. | 加入NaOH溶液然后加热,产生能使湿润的红色石蕊试纸变蓝的气体,则原溶液中一定有NH4+ | |
| C. | 加入用硝酸酸化的BaCl2溶液后有白色沉淀生成,则该无色溶液中一定含有Ag+ | |
| D. | 加入盐酸酸化的BaCl2溶液,有白色沉淀生成,则原溶液中一定有SO42- |
5.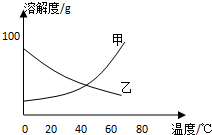 甲、乙两种固体纯净物的溶解度曲线如图所示.在常温下,先在两支试管里分别装入甲、乙两种物质的饱和溶液(试管底部均有未溶解的固体),再放进盛有冰水的烧杯里.下列说法正确的是( )
甲、乙两种固体纯净物的溶解度曲线如图所示.在常温下,先在两支试管里分别装入甲、乙两种物质的饱和溶液(试管底部均有未溶解的固体),再放进盛有冰水的烧杯里.下列说法正确的是( )
 甲、乙两种固体纯净物的溶解度曲线如图所示.在常温下,先在两支试管里分别装入甲、乙两种物质的饱和溶液(试管底部均有未溶解的固体),再放进盛有冰水的烧杯里.下列说法正确的是( )
甲、乙两种固体纯净物的溶解度曲线如图所示.在常温下,先在两支试管里分别装入甲、乙两种物质的饱和溶液(试管底部均有未溶解的固体),再放进盛有冰水的烧杯里.下列说法正确的是( )| A. | 乙溶液中溶质的质量分数增大 | B. | 装甲溶液的试管中剩余的固体减少 | ||
| C. | 试管里甲、乙物质的溶解度都增大 | D. | 两支试管里剩余的固体都增多 |
2.下列气态氢化物中最不稳定的是( )
| A. | CH4 | B. | SiH4 | C. | H2O | D. | HCl |
6.下列实验能达到实验目的且符合实验要求的是( )
| A. |  过滤 | B. |  收集氧气 | ||
| C. |  制备并检验H2的可燃性 | D. |  硫酸稀释 |
3. 在某溶液中滴加氢氧化钠溶液产生沉淀的物质的量(n)与氢氧化钠溶液体积(V)的关系如图所示.该溶液中可能含有的离子组是( )
在某溶液中滴加氢氧化钠溶液产生沉淀的物质的量(n)与氢氧化钠溶液体积(V)的关系如图所示.该溶液中可能含有的离子组是( )
 在某溶液中滴加氢氧化钠溶液产生沉淀的物质的量(n)与氢氧化钠溶液体积(V)的关系如图所示.该溶液中可能含有的离子组是( )
在某溶液中滴加氢氧化钠溶液产生沉淀的物质的量(n)与氢氧化钠溶液体积(V)的关系如图所示.该溶液中可能含有的离子组是( )| A. | Na+、Mg2+、Al3+、NO3-、Cl- | B. | Cu2+、H+、Fe3+、Mg2+、SO42- | ||
| C. | NH4+、H+、Al3+、HCO3-、NO3- | D. | NH4+、H+、Al3+、SO42-、Br- |
4.下列反应的离子方程式书写正确的是( )
| A. | Fe(NO3)3溶液加入足量HI溶液:2Fe3++2I-=2Fe2++I2 | |
| B. | 用H2O2和H2SO4的混合溶液刻蚀铜:Cu+H2O2+2H+=Cu2++2H2O | |
| C. | NH4HCO3溶液中加入足量澄清石灰水:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| D. | 向Ca(OH)2溶液中通入过量CO2:Ca2++2OH-+CO2=CaCO3↓+H2O |