题目内容
10.常温某无色溶液中,由水的电离产生的C(H+)=1×10-12mol/L,则下列肯定能共存的离子组是( )| A. | Cu2+ NO3- SO42- Fe3+ | |
| B. | Cl- S2- Na+ K+ | |
| C. | Cl- Na+ NO3- SO42- | |
| D. | SO32- NH4+ K+ Mg2+ |
分析 无色溶液中不存在Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;由水的电离产生的c(H+)=1×10-12mol/L溶液中存在大量氢离子或氢氧根离子,
A.铁离子、铜离子为有色离子,且二者都与氢氧根离子反应;
B.硫离子与氢离子反应;
C.四种离子之间不发生反应,都不与氢离子、氢氧根离子反应,且为无色离子;
D.亚硫酸根离子与氢离子反应,镁离子与氢氧根离子反应.
解答 解:无色溶液中不存在Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;由水的电离产生的c(H+)=1×10-12mol/L溶液中存在大量氢离子或氢氧根离子,
A.Cu2+、Fe3+为有色离子,且都与氢氧根离子反应,在溶液中一定不能大量共存,故A错误;
B.S2-与氢离子反应,在酸性溶液中不能大量共存,故B错误;
C.Cl-、Na+、NO3-、SO42-之间不反应,都是无色离子,都不与氢离子和氢氧根离子反应,在溶液中一定能够大量共存,故C正确;
D.SO32-与氢离子反应,Mg2+与氢氧根离子反应,在溶液中一定不能大量共存,故D错误;
故选D.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
相关题目
1.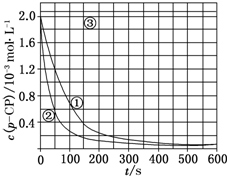 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
【实验设计】控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验:
(1)请完成以下实验设计表(表中不要留空格)
【数据处理】实验测得p-CP的浓度随时间变化的关系如上图
(2)请根据上图实验①曲线,计算降解反应50~150s内的反应速率:v(p-CP)=8.0×10-6mol•L-1•s-1;
【解释与结论】
(3)实验①、②表明温度升高,降解反应速率增大.但后续研究表明:温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:H2O2在温度过高时迅速分解;
(4)实验③得出的结论是:pH等于10时,反应不能(填“能”或“不能”)进行;
【思考与交流】
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10.
 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.【实验设计】控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验:
(1)请完成以下实验设计表(表中不要留空格)
| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 3 | |||
| ③ | 298 | 10 | 6.0 | 0.30 | |
(2)请根据上图实验①曲线,计算降解反应50~150s内的反应速率:v(p-CP)=8.0×10-6mol•L-1•s-1;
【解释与结论】
(3)实验①、②表明温度升高,降解反应速率增大.但后续研究表明:温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:H2O2在温度过高时迅速分解;
(4)实验③得出的结论是:pH等于10时,反应不能(填“能”或“不能”)进行;
【思考与交流】
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10.
18.在用稀硫酸与锌制取氢气的实验中,加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)加入少量硫酸铜溶液可以加快氢气生成速率的原因是硫酸铜与锌反应生成铜,形成铜、锌、稀硫酸原电池,加快化学反应速率;
(2)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度,
适当增加硫酸的浓度或增加锌粒的表面积等(答两种);
(3)为了进一步研究上述反应中硫酸铜的量对氢气生成速率的影响,某学习小组设计了如下6组实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
请完成此实验设计,其中:其中:V2=V5(填“>”、“<”或“=”);V5=30,V6=10,V8=19.5;(填具体数值)
(1)加入少量硫酸铜溶液可以加快氢气生成速率的原因是硫酸铜与锌反应生成铜,形成铜、锌、稀硫酸原电池,加快化学反应速率;
(2)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度,
适当增加硫酸的浓度或增加锌粒的表面积等(答两种);
(3)为了进一步研究上述反应中硫酸铜的量对氢气生成速率的影响,某学习小组设计了如下6组实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实 验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | 15 | 10 | 0 |
15.甲酸的下列性质中,可以证明它是弱电解质的是( )
| A. | 0.1mol/L甲酸溶液的c(H+)=10-3mol/L | |
| B. | 甲酸以任意比与水互溶 | |
| C. | 10mL 1mol/L甲酸恰好与10mL 1mol/L NaOH溶液完全反应 | |
| D. | 甲酸溶液的导电性比一元强酸溶液的弱 |
2.下列说法合理的是( )
| A. | 液态氟化氢中存在氢键,所以其分子比氯化氢更稳定 | |
| B. | 由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S | |
| C. | 能形成+7价含氧酸及其盐的元素一定属于主族元素 | |
| D. | 原子最外层电子数等于6的元素一定属于主族元素 |
19.下列物质对应的电子式书写正确的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
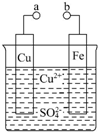 某小组为研究电化学原理,设计如图装置.回答下列问题:
某小组为研究电化学原理,设计如图装置.回答下列问题: