题目内容
下列说法正确的是
A. 某试样焰色反应呈黄色,则试样中肯定不含有K+
B. 过滤操作时,为了加快过滤可以用玻璃棒搅拌漏斗的液体
C. 蒸馏装置中,温度计水银球的位置应该在蒸馏烧瓶的支管口附近
D. 粗盐的提纯实验中,滤液在坩埚中加热蒸发结晶
练习册系列答案
相关题目
8.某小组同学用如下装置电解食盐水,并对电解产物进行探究.
资料显示:
(1)经检验,b极产生的气体是H2,b极附近溶液的pH增大(填“增大”、“减小”、或“不变”);铜丝a应与电源的正(填“正”或“负”)极相连.
(2)同学们分析a极附近生成的白色浑浊是CuCl,则该极的电极反应式是Cu-e-+Cl-=CuCl↓.
(3)①橙黄色沉淀中含有Cu2O,则CuCl转化为Cu2O的原因是CuCl+OH-=CuOH+Cl-、2CuOH=Cu2O+H2O(用方程式表示);
②结合离子在溶液中的运动规律,解释“a极附近沉淀自下而上”变为橙黄色原因是通电时,在阴极产生的OH-向阳极定向移动.
(4)同学们通过实验进一步证实沉淀中含有$\stackrel{+1}{Cu}$:将橙黄色沉淀滤出洗涤后,滴加0.2mol/L H2SO4至过量,应观察到的现象是沉淀溶解,溶液变蓝,且有少量红色固体产生.
(5)同学们根据上述实验提出猜想:电解时,Cu做阳极先被氧化为$\stackrel{+1}{Cu}$.为此,他们用Cu电极电解5mol/L NaOH溶液,实验时观察到阳极产生大量无色气泡,附近溶液变蓝,未见预期的黄色沉淀.
根据现象能否得出“该猜想不成立”的结论,并说明理由:不能,阳极产生的大量O2可能将CuOH氧化.
| 实验装置 | 电解质溶液 | 实验现象 | |
 | 5mol/L NaCl溶液 | a极附近 | b极附近 |
| 开始时,产生白色浑浊并逐渐增加,当沉入U形管底部时部分沉淀变为橙黄色;随后a极附近沉淀自下而上也变为橙黄色 | 产生无色气泡 | ||
| ①氯化亚铜(CuCl)为白色粉末,微溶于水; ②氢氧化亚铜(CuOH)为黄色不溶于水的固体,易脱水分解为红色的Cu2O; ③Cu+水溶液中不稳定,酸性条件下易歧化为Cu2+和Cu; ④氢氧化铜可以溶于浓NaOH得到蓝色溶液. |
(2)同学们分析a极附近生成的白色浑浊是CuCl,则该极的电极反应式是Cu-e-+Cl-=CuCl↓.
(3)①橙黄色沉淀中含有Cu2O,则CuCl转化为Cu2O的原因是CuCl+OH-=CuOH+Cl-、2CuOH=Cu2O+H2O(用方程式表示);
②结合离子在溶液中的运动规律,解释“a极附近沉淀自下而上”变为橙黄色原因是通电时,在阴极产生的OH-向阳极定向移动.
(4)同学们通过实验进一步证实沉淀中含有$\stackrel{+1}{Cu}$:将橙黄色沉淀滤出洗涤后,滴加0.2mol/L H2SO4至过量,应观察到的现象是沉淀溶解,溶液变蓝,且有少量红色固体产生.
(5)同学们根据上述实验提出猜想:电解时,Cu做阳极先被氧化为$\stackrel{+1}{Cu}$.为此,他们用Cu电极电解5mol/L NaOH溶液,实验时观察到阳极产生大量无色气泡,附近溶液变蓝,未见预期的黄色沉淀.
根据现象能否得出“该猜想不成立”的结论,并说明理由:不能,阳极产生的大量O2可能将CuOH氧化.
1.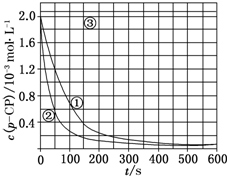 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
【实验设计】控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验:
(1)请完成以下实验设计表(表中不要留空格)
【数据处理】实验测得p-CP的浓度随时间变化的关系如上图
(2)请根据上图实验①曲线,计算降解反应50~150s内的反应速率:v(p-CP)=8.0×10-6mol•L-1•s-1;
【解释与结论】
(3)实验①、②表明温度升高,降解反应速率增大.但后续研究表明:温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:H2O2在温度过高时迅速分解;
(4)实验③得出的结论是:pH等于10时,反应不能(填“能”或“不能”)进行;
【思考与交流】
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10.
 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.【实验设计】控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验:
(1)请完成以下实验设计表(表中不要留空格)
| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 3 | |||
| ③ | 298 | 10 | 6.0 | 0.30 | |
(2)请根据上图实验①曲线,计算降解反应50~150s内的反应速率:v(p-CP)=8.0×10-6mol•L-1•s-1;
【解释与结论】
(3)实验①、②表明温度升高,降解反应速率增大.但后续研究表明:温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:H2O2在温度过高时迅速分解;
(4)实验③得出的结论是:pH等于10时,反应不能(填“能”或“不能”)进行;
【思考与交流】
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10.
18.在用稀硫酸与锌制取氢气的实验中,加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)加入少量硫酸铜溶液可以加快氢气生成速率的原因是硫酸铜与锌反应生成铜,形成铜、锌、稀硫酸原电池,加快化学反应速率;
(2)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度,
适当增加硫酸的浓度或增加锌粒的表面积等(答两种);
(3)为了进一步研究上述反应中硫酸铜的量对氢气生成速率的影响,某学习小组设计了如下6组实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
请完成此实验设计,其中:其中:V2=V5(填“>”、“<”或“=”);V5=30,V6=10,V8=19.5;(填具体数值)
(1)加入少量硫酸铜溶液可以加快氢气生成速率的原因是硫酸铜与锌反应生成铜,形成铜、锌、稀硫酸原电池,加快化学反应速率;
(2)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度,
适当增加硫酸的浓度或增加锌粒的表面积等(答两种);
(3)为了进一步研究上述反应中硫酸铜的量对氢气生成速率的影响,某学习小组设计了如下6组实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实 验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | 15 | 10 | 0 |
19.下列物质对应的电子式书写正确的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |

