题目内容
14.温度为500℃时,反应4NH3+5O2?4NO+6H2O在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率为( )| A. | v(O2)=0.01 mol/(L•s) | B. | v(NO)=0.08 mol/(L•s) | ||
| C. | v(H2O)=0.03 mol/(L•s) | D. | v(NH3)=0.002 mol/(L•s) |
分析 根据v=$\frac{△c}{△t}$计算v(NO),在根据速率之比等于化学计量数之比计算用其它物质表示的反应速率.
解答 解:半分钟后NO的物质的量增加了0.3mol,所以用NO表示的反应速率为v(NO)=$\frac{\frac{0.3mol}{5L}}{30s}$=0.002mol/(L•s).
A、根据速率之比等于化学计量数之比,所以v(O2)=$\frac{5}{4}$v(NO)=$\frac{5}{4}$×0.002mol/(L•s)=0.0025mol/(L•s),故A错误;
B、半分钟后NO的物质的量增加了0.3mol,所以用NO表示的反应速率为v(NO)=$\frac{\frac{0.3mol}{5L}}{30s}$=0.002mol/(L•s),故B错误;
C、根据速率之比等于化学计量数之比,所以v(H2O)=1.5v(NO)=1.5×0.002mol/(L•s)=0.003mol/(L•s),故C错误;
D、根据速率之比等于化学计量数之比,所以v(NH3)=v(NO)=0.002mol/(L•s),故D正确.
故选D.
点评 本题考查化学反应速率,难度不大,注意反应速率计算常用两种方法定义法与化学计量数法,根据情况选择使用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列说法合理的是( )
| A. | 液态氟化氢中存在氢键,所以其分子比氯化氢更稳定 | |
| B. | 由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S | |
| C. | 能形成+7价含氧酸及其盐的元素一定属于主族元素 | |
| D. | 原子最外层电子数等于6的元素一定属于主族元素 |
19.下列物质对应的电子式书写正确的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
6.若某阴离子的结构示意图如图所示,则该元素在元素周期表中的位置可能是( )
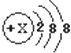
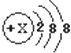
| A. | 第四周期IA | B. | 第三周期0族 | C. | 第二周期VIIA | D. | 第三周期VIIA族 |
3.下列对元素周期表说法错误的是( )
| A. | 7个横行 | B. | 7个周期 | C. | 18纵行 | D. | 18个族 |
 (1)肼(N2H4)又称联氨,是一种可燃性液体,可用作火箭燃料.已知在101kPa,320g N2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧的热化学方程式是:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-62.4KJ/mol
(1)肼(N2H4)又称联氨,是一种可燃性液体,可用作火箭燃料.已知在101kPa,320g N2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧的热化学方程式是:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-62.4KJ/mol