题目内容
19.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | pH=1的H2SO4溶液,含H+的数目为2NA | |
| B. | 1mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 | |
| C. | 273K,101kPa下,14g乙烯与丙烯混合物中含有碳原子数目为3NA | |
| D. | 0.2mol C2H6O分子中一定存在0.2NA个碳碳单键 |
分析 A、溶液体积不明确;
B、钠反应后变为+1价;
C、乙烯和丙烯的最简式均为CH2;
D、C2H6O可能为乙醇,还可能为二甲醚.
解答 解:A、溶液体积不明确,故溶液中的氢离子的个数无法计算,故A错误;
B、钠反应后变为+1价,故1mol钠失去NA个电子,故B正确;
C、乙烯和丙烯的最简式均为CH2,故14g混合物中含有的CH2的物质的量为1mol,故含NA个碳原子,故C错误;
D、C2H6O可能为乙醇,还可能为二甲醚,当为二甲醚时,结构中无碳碳单键,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
9.下图是常用的化学仪器,其中常用于物质的分离与提纯的是( )
| A. |  | B. |  | C. |  | D. |  |
10.事实上,许多非金属氧化物在一定条件下能与Na2O2反应,且反应极有规律,如Na2O2+SO2=Na2SO42Na2O2+2SO3=2Na2SO4+O2据此,你认为下列反应方程式中正确的是( )
| A. | 2Na2O2+2 Mn2O7=4Na2MnO4+O2 | B. | Na2O2+2NO2=2NaNO2+O2 | ||
| C. | 2Na2O2+2N2O3=4NaNO2+O2 | D. | 2Na2O2+2N2O4=4NaNO3 |
14.将下列物质分别加入到溴水中,溴水中溴单质的物质的量减少的是( )
| A. | KCl | B. | KBr | C. | CCl4 | D. | I2 |
11.下列离子方程式正确的是( )
| A. | 氯化铝溶液中加入过量氨水:A13++4NH3•H2O═4NH4++2H2O+A1O2- | |
| B. | FeBr2溶液中通入足量的氯气:2Fe2++2Br-+2C12═2Fe3++Br2+4C1- | |
| C. | 硫酸亚铁溶液中加入用硫酸酸化的双氧水Fe2++2H++H2O2═Fe3++2H2O | |
| D. | 在通入过量SO2后的NaOH溶液中加足量的溴水(不考虑SO2的溶解):HSO3-+Br2+H2O═3H++2Br-+SO42- |
14.下列叙述正确的是( )
| A. | SO2具有还原性,故可作漂白剂 | |
| B. | Na的金属活动性比Mg强,故可用Na与MgCl2溶液反应制Mg | |
| C. | 浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色 | |
| D. | CaCO3在水中的溶解度很小,故CaCO3为弱电解质 |
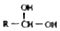 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$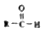 请根据如图回答:
请根据如图回答: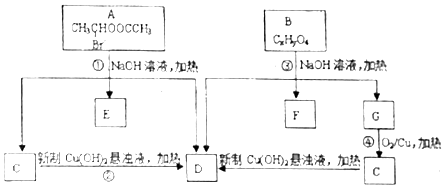
 .
. ;②CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O+3H2O.
;②CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O+3H2O.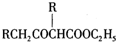 +C2H3OH,请以G为唯一有机试剂合成乙酰乙酸乙酯(CH3COCH2COOC2H5),设计合成路线(其他试剂任选).
+C2H3OH,请以G为唯一有机试剂合成乙酰乙酸乙酯(CH3COCH2COOC2H5),设计合成路线(其他试剂任选).