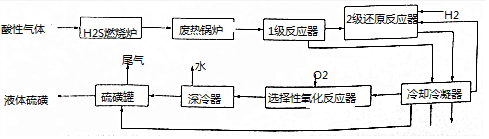
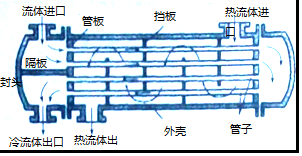
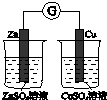
题目内容
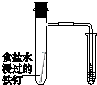
8.某兴趣小组利用如图实验装置制备氯气并检验氯气的性质.
(1)仪器a 的名称是分液漏斗.
(2)装置A中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(3)下列说法不正确的是BC.
A.装置B中溶液变蓝,说明氯的非金属性强于碘
B.装置C中布条褪色,说明氯气有强氧化性
C.装置D中产生白色沉淀,说明有HCl挥发出来
D.装置E中试剂可以是NaOH溶液,作用是吸收尾气.
分析 (1)依据仪器形状说出其名称;
(2)浓盐酸与二氧化锰在加热条件下反应生成氯化锰和氯气、水;
(3)氯气溶于水得到溶液为氯水,部分与水反应生成氯化氢和次氯酸,依据氯水成分及性质解答.
解答 解:(1)依据仪器形状可知仪器a 的名称是分液漏斗;
故答案为:分液漏斗;
(2)加热条件下,实验室用浓盐酸和二氧化锰制取氯气,二者反应生成氯化锰、氯气和水,离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(3)氯气溶于水得到溶液为氯水,部分与水反应生成氯化氢和次氯酸,氯水中含有:氯气、次氯酸、水分子,氯离子、氢离子、次氯酸根离子,
A.氯气氧化性强于碘,能够与碘化钾反应生成单质碘,碘遇到淀粉变蓝,故A正确;
B.氯气本身不具有漂白性,能够与水反应生成次氯酸,次氯酸具有漂白性,故B错误;
C.氯气与D溶液反应生成氯水,氯水中含有氯离子,所以能够与硝酸银反应生成白色沉淀,故C错误;
D.氯气能够与氢氧化钠反应生成氯化钠,次氯酸钠和水,可以用氢氧化钠吸收过量的氯气,故D正确;
故选:BC.
点评 本题考查了氯气的实验室制备及 性质检验,明确氯气制备原理及氯气的性质是解题关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | pH=1的H2SO4溶液,含H+的数目为2NA | |
| B. | 1mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 | |
| C. | 273K,101kPa下,14g乙烯与丙烯混合物中含有碳原子数目为3NA | |
| D. | 0.2mol C2H6O分子中一定存在0.2NA个碳碳单键 |
16.下列各组物质的熔点均与所含化学键的键能有关的是( )
| A. | CaO 与CO2 | B. | NaCl与HCI | C. | SiC 与SiO2 | D. | CCl4与I2 |
3.下列说法不正确的是( )
| A. | 12C与14C为不同核素 | |
| B. | 石墨和C60的互为同素异形体 | |
| C. | H2O和D2O互为同位素 | |
| D. | 氨基酸分子中均含有羧基(-COOH)和氨基(-NH2) |
13.美国通用原子能公司(GA)提出的碘硫热化学循环是由反应Ⅰ、Ⅱ、Ⅲ三步反应组成的(如图所示),下列有关说法正确的是( )
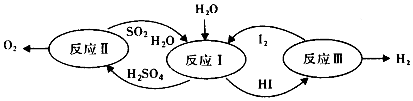

| A. | 设计该循环是为了制取能源气体O2 | |
| B. | 整个循环过程中产生1mol O2的同时产生1molH2 | |
| C. | 图中反应Ⅰ、Ⅱ、Ⅲ均可在常温常压下进行 | |
| D. | 图中反应Ⅰ、Ⅱ、Ⅲ均为氧化还原反应 |
20.关于下列各实验装置的叙述中,不正确的是( )
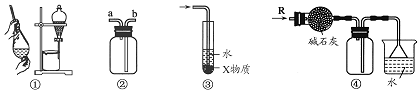

| A. | 装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体 | |
| B. | 装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸 | |
| C. | 装置①可用于分离C2H5OH和H2O的混合物 | |
| D. | 装置④可用于干燥、收集NH3,并吸收多余的NH3 |
 如下图的转化关系中,已知A是由短周期元素组成的酸式盐.D、Y、H为气体,X为无色液体,G和K均是常见的强酸.H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子.
如下图的转化关系中,已知A是由短周期元素组成的酸式盐.D、Y、H为气体,X为无色液体,G和K均是常见的强酸.H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子. ;
;