题目内容
计算:
(1)把6.2g的Na2O溶解于93.8g水中,得到的溶液的溶质质量分数是多少?
(2)把4.6g金属钠溶解于95.6g水中,得到的溶液的溶质的质量分数是多少?
(3)把7.8g Na2O2 溶解于93.8g水中,得到的溶液的溶质质量分式是多少?
(1)把6.2g的Na2O溶解于93.8g水中,得到的溶液的溶质质量分数是多少?
(2)把4.6g金属钠溶解于95.6g水中,得到的溶液的溶质的质量分数是多少?
(3)把7.8g Na2O2 溶解于93.8g水中,得到的溶液的溶质质量分式是多少?
考点:钠的重要化合物,化学方程式的有关计算
专题:计算题,几种重要的金属及其化合物
分析:(1)氧化钠与水反应生成氢氧化钠,溶质为氢氧化钠,溶液的质量等于氧化钠质量加水的质量;
(2)钠与水反应生成氢氧化钠和氢气,溶质为氢氧化钠,溶液的质量等于钠的质量加水的质量减去氢气的质量;
(3)过氧化钠与水反应生成氢氧化钠和氧气,溶质为氢氧化钠,溶液的质量为过氧化钠的质量加水的质量减去氧气的质量.
(2)钠与水反应生成氢氧化钠和氢气,溶质为氢氧化钠,溶液的质量等于钠的质量加水的质量减去氢气的质量;
(3)过氧化钠与水反应生成氢氧化钠和氧气,溶质为氢氧化钠,溶液的质量为过氧化钠的质量加水的质量减去氧气的质量.
解答:
解:(1)氧化钠与水反应:
Na20+2H2O=2NaOH
62 80
6.2g m(NaOH) m(NaOH)=8g
溶液的溶质的质量分数=
×100%=8%;
答:得到的溶液的溶质质量分数是8%;
(2)钠与水反应:
2Na+2H2O═2NaOH+H2↑
46 80 2
4.6g m(NaOH) m(H2) 解得:m(NaOH)=8g;m(H2)=0.2g;
溶液的溶质的质量分数:
×100%=8%;
答:得到的溶液的溶质的质量分数是8%;
(3)过氧化钠与水反应:
2Na2O2 +2H2O=4NaOH+O2↑
156 160 32
7.8g m(NaOH) m(O2) 解得:m(NaOH)=8g m(O2)=1.6g
溶液的溶质的质量分数:
×100%=8%;
答:得到的溶液的溶质的质量分数是8%.
Na20+2H2O=2NaOH
62 80
6.2g m(NaOH) m(NaOH)=8g
溶液的溶质的质量分数=
| 8g |
| 6.2g+93.8g |
答:得到的溶液的溶质质量分数是8%;
(2)钠与水反应:
2Na+2H2O═2NaOH+H2↑
46 80 2
4.6g m(NaOH) m(H2) 解得:m(NaOH)=8g;m(H2)=0.2g;
溶液的溶质的质量分数:
| 8g |
| 4.6g+95.6g-0.2g |
答:得到的溶液的溶质的质量分数是8%;
(3)过氧化钠与水反应:
2Na2O2 +2H2O=4NaOH+O2↑
156 160 32
7.8g m(NaOH) m(O2) 解得:m(NaOH)=8g m(O2)=1.6g
溶液的溶质的质量分数:
| 8g |
| 7.8g+93.8g-1.6g |
答:得到的溶液的溶质的质量分数是8%.
点评:本题考查了溶液中溶质的质量分数计算,明确发生的化学反应,准确判断溶质和溶液的质量是解题关键,题目难度不大.

练习册系列答案
相关题目
荧光素(X)常用于钞票等防伪印刷,下列关于它的说法正确的是( )
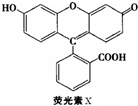

| A、荧光素的分子式为C20H14O5 |
| B、1molX最多能与9mol氢气反应 |
| C、1molX与足量的浓溴水反应,最多消耗4molBr2 |
| D、X能与甲醛发生缩聚反应 |
下列说法正确的是( )
| A、1mol葡萄糖可与5mol乙醇发生酯化反应 |
| B、油脂氢化、氨基酸形成多肽、蛋白质水解都属于取代反应 |
| C、可用碘水和银氨溶液鉴别葡萄糖、麦芽糖和淀粉三种物质 |
| D、乙二醇、甲醛、α-羟基丙酸(CH3-CHOH-COOH)都可发生缩聚反应 |
把锌片投入盛有盐酸的敞口容器里,在下列因素中:①盐酸的浓度;②锌片的表面积;③溶液的温度;④氯离子的浓度;⑤溶液中加入少量CuSO4,对反应速率有影响的是( )
| A、①② | B、③④⑤ |
| C、①②③④ | D、①②③⑤ |
常温时,下列关于电解质溶液的叙述正确的是( )
| A、物质的量相同的两种盐NaX、NaY的溶液,pH依次为9、10,则HX的酸性比HY弱 |
| B、相同体积、相同物质的量浓度的盐酸与醋酸溶液,分别与同浓度的氢氧化钠溶液恰好完全反应时,醋酸消耗的氢氧化钠溶液体积多 |
| C、pH=11的NaOH溶液和pH=11的氨水分别稀释100倍,前者pH一定小于后者 |
| D、分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
对于化学反应方向的判断,下列说法中正确的是( )
| A、温度、压强一定时,熵减小的放热反应一定能自发进行 |
| B、温度、压强一定时,焓判据共同决定一个化学反应自发进行的方向 |
| C、反应焓变是决定反应能否自发进行的唯一因素 |
| D、固体的溶解过程与熵变无关 |