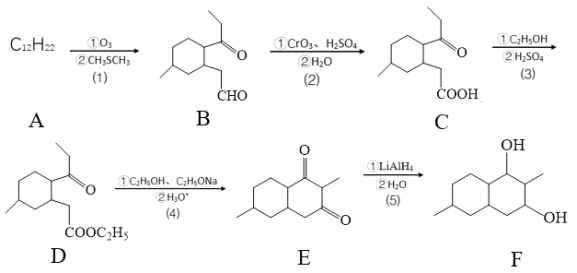
题目内容
【题目】天津大学某科研团队创新地提出了一种基于电化学冶金原理并利用电解质去耦合策略,在电池中同时进行MnO2和Zn可逆溶解/电沉积的储能机制,其工作原理如图,电池放电总反应为Zn+4OH-+MnO2+4H+![]() Zn(OH)
Zn(OH)![]() +Mn2++2H2O。下列说法不正确的是( )
+Mn2++2H2O。下列说法不正确的是( )
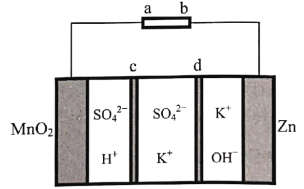
A.充电时,Zn电极区为阴极区
B.c为阴离子交换膜,d为阳离子交换膜
C.放电时,正极电极反应式为MnO2+4H++2e-=+Mn2++2H2O
D.充电时,电子的流向为a→MnO2→电解质溶液→Zn→b
【答案】D
【解析】
根据电池放电总反应Zn+4OH-+MnO2+4H+![]() Zn(OH)
Zn(OH)![]() +Mn2++2H2O,放电时,Zn失电子,作负极,电极反应式为:Zn-2e-+4OH-= Zn(OH)
+Mn2++2H2O,放电时,Zn失电子,作负极,电极反应式为:Zn-2e-+4OH-= Zn(OH)![]() ,MnO2得电子,作正极,电极反应式为:MnO2+4H++2e-=+Mn2++2H2O。
,MnO2得电子,作正极,电极反应式为:MnO2+4H++2e-=+Mn2++2H2O。
A. 放电时,Zn失电子,作负极,充电时,Zn电极区为阴极区,A正确;
B. 放电时,负极消耗OH-,K+通过阳离子交换膜d向左移动,正极消耗H+,![]() 通过阴离子交换膜c向右移动,B正确;
通过阴离子交换膜c向右移动,B正确;
C. 放电时,MnO2得电子,作正极,正极电极反应式为:MnO2+4H++2e-=+Mn2++2H2O,C正确;
D. 充电时,电子不能通过电解质溶液,D错误;故答案为:D。

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目