题目内容
5.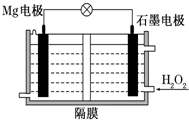 Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )| A. | Mg电极是该电池的正极 | B. | H2O2在石墨电极上发生氧化反应 | ||
| C. | 石墨电极附近溶液的pH增大 | D. | 电子从石墨电极移向Mg电极 |
分析 镁、过氧化氢和海水形成原电池,镁做负极发生氧化反应,过氧化氢在正极上发生还原反应,过氧化氢做氧化剂被还原为水,溶液pH增大,电子从负极流向正极,据此分析.
解答 解:A、组成的原电池的负极被氧化,镁为负极,而非正极,故A错误;
B、双氧水作为氧化剂,在石墨上被还原变为水和氢氧根离子,发生还原反应,故B错误;
C、双氧水作为氧化剂,在石墨上被还原变为氢氧根离子,电极反应为,H2O2+2e-=2OH-,故溶液pH值增大,故C正确;
D.电子从负极流向正极,即从Mg电极移向石墨电极,故D错误;
故选C.
点评 本题考查了原电池原理的分析判断,把握电极名称的判断方法和电极反应式的书写方法是解题的关键,题目难度不大,侧重于学生的分析能力的考查.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15. 一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,
一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,
发生如下反应:CO(g)+H2O (g)═CO2(g) 十 H2 (g);△H<0
(1)在850℃时,CO和H2O浓度变化如图,则 0~4min的平均反应速率v(CO2)=0.03mol•L-1•min-1
(2)t1℃时,在相同容器中发生上述反应,各物质的浓度变化如表:
计算t1℃该反应的平衡常数K=0.5.
(3)t2℃时,化学反应CO (g)+H2O (g)?CO2(g)+H2 (g)的平衡浓度符合c(CO2)•c(H2)═2c(CO)•c(H2O),则t2℃<850℃,判断依据是:t2℃的平衡常数为2,大于850℃的平衡常数1,平衡右移
(4)在t1℃达平衡时,又充入CO,再次平衡时,混合气体中H2O的体积分数将减小(填“增大”、“减小”或“无法确定”) H2O的转化率将增大(填“增大”、“减小”或“无法确定”)
(5))判断该反应达到化学平衡状态的依据是AB(填序号):
A.V(正)(CO)=V (逆)(CO2)
B.CO消耗速率等于H2的消耗速率
C. 容器内压强保持不变
D.混合气体的密度保持不变
E.容器中气体的平均相对分子质量不随时间而变化
F.混合气体的质量保持不变.
 一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,
一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,发生如下反应:CO(g)+H2O (g)═CO2(g) 十 H2 (g);△H<0
(1)在850℃时,CO和H2O浓度变化如图,则 0~4min的平均反应速率v(CO2)=0.03mol•L-1•min-1
(2)t1℃时,在相同容器中发生上述反应,各物质的浓度变化如表:
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
(3)t2℃时,化学反应CO (g)+H2O (g)?CO2(g)+H2 (g)的平衡浓度符合c(CO2)•c(H2)═2c(CO)•c(H2O),则t2℃<850℃,判断依据是:t2℃的平衡常数为2,大于850℃的平衡常数1,平衡右移
(4)在t1℃达平衡时,又充入CO,再次平衡时,混合气体中H2O的体积分数将减小(填“增大”、“减小”或“无法确定”) H2O的转化率将增大(填“增大”、“减小”或“无法确定”)
(5))判断该反应达到化学平衡状态的依据是AB(填序号):
A.V(正)(CO)=V (逆)(CO2)
B.CO消耗速率等于H2的消耗速率
C. 容器内压强保持不变
D.混合气体的密度保持不变
E.容器中气体的平均相对分子质量不随时间而变化
F.混合气体的质量保持不变.
14.下列理解正确的是( )
| A. | 摩尔是国际单位制中七个基本物理量之一 | |
| B. | 摩尔是物质的量的单位,简称摩,符号为mol | |
| C. | 摩尔可以把物质的宏观数量与微观粒子的数量联系起来 | |
| D. | 国际上规定,0.012 kg碳原子中所含有的碳原子数目为1摩 |
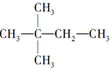 ,则A的结构简式为(CH3)3CCH=CH2.
,则A的结构简式为(CH3)3CCH=CH2. A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题: .
.