题目内容
在某钠盐溶液中,除Cl-之外可能还含有等物质的量的下列阴离子中的一种或多种:SO32-、CO32-、SiO32-、I-、NO3-、SO42-.在此溶液中加入过量盐酸,产生气泡,溶液颜色变深,但仍澄清,并且原溶液中的阴离子种类减少了3种.试回答下列问题.
(1)原溶液中是否有SiO32-? (填“有”或“没有”),判断理由是 .(用离子方程式表示)
(2)生成的气体中一定有 .它具有的性质是 (填字母序号).
A、无色无味 B、无色有刺激性气味 C、属于大气污染物 D、难溶于水
E、能被NaOH溶液吸收
(3)原溶液中可能含有的阴离子是 .
(4)溶液中减少的离子是 ,原因是 (用离子方程式表示).
(1)原溶液中是否有SiO32-?
(2)生成的气体中一定有
A、无色无味 B、无色有刺激性气味 C、属于大气污染物 D、难溶于水
E、能被NaOH溶液吸收
(3)原溶液中可能含有的阴离子是
(4)溶液中减少的离子是
考点:物质的检验和鉴别的实验方案设计
专题:物质检验鉴别题
分析:在此溶液中加入过量盐酸,产生气泡,溶液颜色变深,但仍澄清,则一定不含SiO32-,溶液颜色变深,一定是生成了碘单质,一定含有I-、NO3-,并且原溶液中的阴离子种类减少了3种,据此确定另一种离子是亚硫酸根离子,亚硫酸根离子具有还原性,能被硝酸氧化为硫酸根离子,根据离子的性质以及现象知识来回答.
解答:
解:在此溶液中加入过量盐酸,产生气泡,溶液颜色变深,但仍澄清,则一定不含SiO32-,溶液颜色变深,一定是生成了碘单质,一定含有I-、NO3-,并且原溶液中的阴离子种类减少了3种,亚硫酸根离子具有还原性,根据6I-+8H++2NO3-=3I2+2NO↑+4H2O、3SO32-+2H++2NO3-=3SO42-+2NO↑+H2O知道,一定含有亚硫酸根离子,可能含有硫酸根离子.
(1)在此溶液中加入过量盐酸,仍澄清,则一定不含SiO32-,因为SiO32-+2H+=H2SiO3↓,硅酸是白色沉淀,故答案为:SiO32-+2H+=H2SiO3↓
(2)根据6I-+8H++2NO3-=3I2+2NO↑+4H2O、3SO32-+2H++2NO3-=3SO42-+2NO↑+H2O知道生成的气体中一定有NO,是一种无色无味、难溶于水的有毒气体,属于大气污染物,是不成盐氧化物,不能被NaOH溶液吸收,故答案为:ACD;
(3)原溶液中可能含有的阴离子是SO42-,故答案为:SO42-;
(4)根据6I-+8H++2NO3-=3I2+2NO↑+4H2O、3SO32-+2H++2NO3-=3SO42-+2NO↑+H2O知道,加入盐酸溶液中减少的3种离子是SO32-、I-、NO3-,
故答案为:SO32-、I-、NO3-;6I-+8H++2NO3-=3I2+2NO↑+4H2O、3SO32-+2H++2NO3-=3SO42-+2NO↑+H2O.
(1)在此溶液中加入过量盐酸,仍澄清,则一定不含SiO32-,因为SiO32-+2H+=H2SiO3↓,硅酸是白色沉淀,故答案为:SiO32-+2H+=H2SiO3↓
(2)根据6I-+8H++2NO3-=3I2+2NO↑+4H2O、3SO32-+2H++2NO3-=3SO42-+2NO↑+H2O知道生成的气体中一定有NO,是一种无色无味、难溶于水的有毒气体,属于大气污染物,是不成盐氧化物,不能被NaOH溶液吸收,故答案为:ACD;
(3)原溶液中可能含有的阴离子是SO42-,故答案为:SO42-;
(4)根据6I-+8H++2NO3-=3I2+2NO↑+4H2O、3SO32-+2H++2NO3-=3SO42-+2NO↑+H2O知道,加入盐酸溶液中减少的3种离子是SO32-、I-、NO3-,
故答案为:SO32-、I-、NO3-;6I-+8H++2NO3-=3I2+2NO↑+4H2O、3SO32-+2H++2NO3-=3SO42-+2NO↑+H2O.
点评:本题考查了常见离子的检验,题目难度中等,注意掌握常见离子的性质及检验方法,推断离子的存在时,一定注意做到推断的严密性、科学性.

练习册系列答案
相关题目
某强碱性溶液中含有的离子是K+、NH4+、A13+、AlO2-、CO32-、SiO32-、Cl-中的某几种,现进行如下实验:
①取少量的溶液用硝酸酸化后,该溶液无沉淀生成;
②另取一定量原溶液,逐滴加入盐酸至过量,发生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失.
③另取一定量的原溶液中加入5mL0.2mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.2153g.
下列说法中正确的是( )
①取少量的溶液用硝酸酸化后,该溶液无沉淀生成;
②另取一定量原溶液,逐滴加入盐酸至过量,发生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失.
③另取一定量的原溶液中加入5mL0.2mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.2153g.
下列说法中正确的是( )
| A、该溶液中一定不含NH4+、A13+、SiO32-、Cl- |
| B、该溶液中一定含有A13+、CO32-、Cl- |
| C、该溶液中一定含有K+、AlO2-、CO32-、Cl- |
| D、Cl-可能含有 |
下列实验方案合理的是( )
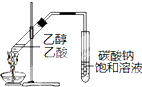

| A、配制银氨溶液:质量分数为2% 氨水中加入过量的硝酸银溶液 |
| B、制备乙酸乙酯:用如右图所示的实验装置 |
| C、鉴定溴乙烷中的溴原子:向溴乙烷中加入硝酸酸化的硝酸银溶液 |
| D、鉴别地沟油和矿物油:加入足量氢氧化钠溶液加热 |
基态铬原子的电子排布式是( )
| A、1S22S22p63S23p64S14p5 |
| B、1S22S22p63S23p63d6 |
| C、1S22S22p63S23p64S23d4 |
| D、1S22S22p63S23P63d54S1 |
设NA是阿伏加德罗常数的数值,下列说法正确的是( )
| A、常温下,50g SO2和CO2的混合气体中可能含有2NA个氧原子 |
| B、1mol Cl2与足量的铁反应,转移的电子数为3NA |
| C、1L0.1mol?L-1氨水含有0.1lNA个OH- |
| D、1mol甲醇中含有C-H键的数目为3NA |
 某溶液中可能含有H+、NH4+、Na+、Mg2+、Al3+、Fe2+、CI-、CO32-、NO3-中的几种.①若加入锌粒,产生无色无味的氢气;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.回答下列问题:
某溶液中可能含有H+、NH4+、Na+、Mg2+、Al3+、Fe2+、CI-、CO32-、NO3-中的几种.①若加入锌粒,产生无色无味的氢气;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.回答下列问题: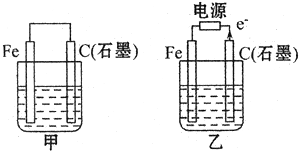 (1)若甲、乙两烧杯中均盛有饱和NaCI溶液.
(1)若甲、乙两烧杯中均盛有饱和NaCI溶液. 氮元素可以形成多种化合物.
氮元素可以形成多种化合物.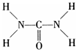 ,则尿素分子中C和N原子的杂化方式分别是
,则尿素分子中C和N原子的杂化方式分别是