题目内容
18.下列物质性质的递变关系正确的有( )①稳定性:HCl>H2S>PH3
②离子半径:O2->F->Na+>Mg2+>Al3+
③碱性:NaOH>KOH>Ca(OH)2>Mg(OH)2
④最高化合价:Cl>Si>Al>F
⑤沸点:HF>HCl>HBr>HI.
| A. | ①②④⑤ | B. | ①②④ | C. | ①②⑤ | D. | ①④⑤ |
分析 ①非金属性越强,对应氢化物越稳定;
②具有相同电子排布的离子中,原子序数大的离子半径小;
③金属性越强,对应碱的碱性越强;
④F无正价,最外层电子数等于最高正化合价;
⑤HF分子间含氢键,沸点最高,同类型的分子中相对分子质量大的沸点高.
解答 解:①非金属性越强,对应氢化物越稳定,则稳定性:HCl>H2S>PH3,故正确;
②具有相同电子排布的离子中,原子序数大的离子半径小,则离子半径:O2->F->Na+>Mg2+>Al3+,故正确;
③金属性越强,对应碱的碱性越强,则碱性:KOH>Ca(OH)2>NaOH>Mg(OH)2,故错误;
④F无正价,最外层电子数等于最高正化合价,则最高化合价:Cl>Si>Al>F,故正确;
⑤HF分子间含氢键,沸点最高,同类型的分子中相对分子质量大的沸点高,则沸点:HF>HI>HBr>HCl,故错误;
故选B.
点评 本题考查元素周期律和周期表,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.下列说法正确的是( )
| A. | 已知二元酸H2A在溶液中的电离方程式为:H2A═H++HA- HA-?H++A2-,则NaHA溶液中离子浓度的关系有:c(Na+)═c(A2-)+c(HA-)+c(H2A)和c(A2-)═c(H+)-c(OH-) | |
| B. | 已知:室温时Ka(HA)=10-5.则室温时 0.1mol/LNaA溶液的pH约为10 | |
| C. | HCN溶液加水稀释的过程中$\frac{c({H}^{+})}{c(C{N}^{-})}$减小 | |
| D. | 向明矾溶液中逐滴滴入Ba(OH)2溶液至硫酸根离子刚好完全沉淀时,所得溶液中离子浓度关系有:c(K+)>c(AlO2-)>c(OH-)>c(H+) |
13.某研究性学习小组设计实验用30mL浓硫酸与10mL无水乙醇共热制备乙烯气体、并测定乙醇转化成乙烯的转化率.已知生成的乙烯气体中含有SO2、CO2、乙醇和乙醚等杂质.有关数据如表:
(1)制备乙烯
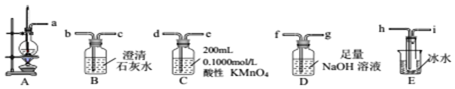
①从A~E中选择必要的装置完成实验,并按气流方向连接的顺序为a→h、i→f、g→d(填仪器接口的字母编号).
②D装置中发生反应的离子方程式SO2+2OH-=SO32-+H2O、CO2+2OH-=CO32-+H2O实验后,检验D溶液中含有CO32-的实验方案为取少许D溶液于试管中,先滴加足量的双氧水,然后再加入一定量的硫酸,产生能使澄清石灰水浑浊的气体,则证明D溶液中含有CO32-.
③E装置的主要作用是冷凝并收集乙醚.
(2)测定乙烯
反应结束后,用移液管移取C中溶液20mL(不考虑溶液体积变化)于锥形瓶中,先加入约2mL稀硫酸酸化.再用0.1000mol/L的Na2C2O4溶液滴定未反应完的KMnO4.
已知:C2H4$→_{H+}^{KMnO_{4}}$CO2+H2O;C2O42- $→_{H+}^{KMnO_{4}}$CO2+H2O;MnO4-→Mn2+
④以下情况使得测定乙烯的量偏高的是CD
A.在用蒸馏水清洗碱式滴定管后,直接装Na2C2O4标准液
B.锥形瓶清洗干净后残有大量水珠
C.滴定前,滴定管内无气泡,滴定后有气泡
D.读数时,滴定前平视,滴定后俯视
⑤油定终点的现象为溶液由粉红色变成无色,且半分钟内不变色.
⑥已知用去Na2C2O4溶液20.00mL,则乙醇转化成乙烯的转化率为2.94%.
| 熔点/℃ | 沸点/℃ | 溶解性 | 颜色状态 | 密度g/cm3 | |
| 乙醇 | -114.1 | 78.3 | 与水、有机溶剂互溶 | 无色液体 | 0.79 |
| 乙醚 | -116.2 | 34.5 | 不溶于水,易溶于有机溶剂 | 无色液体 | 0.7135 |

①从A~E中选择必要的装置完成实验,并按气流方向连接的顺序为a→h、i→f、g→d(填仪器接口的字母编号).
②D装置中发生反应的离子方程式SO2+2OH-=SO32-+H2O、CO2+2OH-=CO32-+H2O实验后,检验D溶液中含有CO32-的实验方案为取少许D溶液于试管中,先滴加足量的双氧水,然后再加入一定量的硫酸,产生能使澄清石灰水浑浊的气体,则证明D溶液中含有CO32-.
③E装置的主要作用是冷凝并收集乙醚.
(2)测定乙烯
反应结束后,用移液管移取C中溶液20mL(不考虑溶液体积变化)于锥形瓶中,先加入约2mL稀硫酸酸化.再用0.1000mol/L的Na2C2O4溶液滴定未反应完的KMnO4.
已知:C2H4$→_{H+}^{KMnO_{4}}$CO2+H2O;C2O42- $→_{H+}^{KMnO_{4}}$CO2+H2O;MnO4-→Mn2+
④以下情况使得测定乙烯的量偏高的是CD
A.在用蒸馏水清洗碱式滴定管后,直接装Na2C2O4标准液
B.锥形瓶清洗干净后残有大量水珠
C.滴定前,滴定管内无气泡,滴定后有气泡
D.读数时,滴定前平视,滴定后俯视
⑤油定终点的现象为溶液由粉红色变成无色,且半分钟内不变色.
⑥已知用去Na2C2O4溶液20.00mL,则乙醇转化成乙烯的转化率为2.94%.
3.有A、B、C三种主族元素,已知A元素原子的价电子构型为nsn,B元素原子的M层上有两个未成对电子,C元素原子L层的p轨道上有一对成对电子,由这三种元素组成的化合物的化学式不可能是( )
| A. | A3BC4 | B. | A2BC4 | C. | A2BC3 | D. | A4BC4 |


 .
. .
. .
.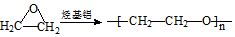 .
.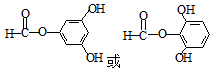 .
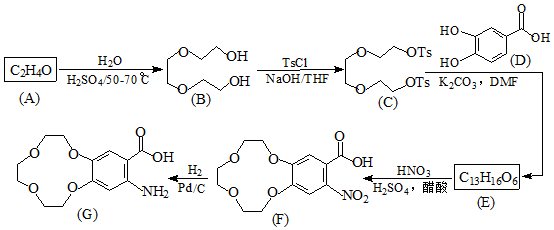
.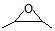 )和邻二苯酚为原料(其它试剂任选),设计制备
)和邻二苯酚为原料(其它试剂任选),设计制备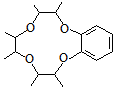 的合成路线.
的合成路线. 已知A、B、C、D、X、Y、Z七种短周期主族元素的原子序数依次增大,A是元素周期表中原子半径最小的,B的最高价氧化物的水化物与其氢化物反应生成盐,且B的核电荷数比Y的最外层电子数多1.C原子的最外层电子数是次外层电子数的3倍,D原子半径在同周期中除稀有气体外最大,X是同周期中简单离子半径最小的元素.请回答下列问题:
已知A、B、C、D、X、Y、Z七种短周期主族元素的原子序数依次增大,A是元素周期表中原子半径最小的,B的最高价氧化物的水化物与其氢化物反应生成盐,且B的核电荷数比Y的最外层电子数多1.C原子的最外层电子数是次外层电子数的3倍,D原子半径在同周期中除稀有气体外最大,X是同周期中简单离子半径最小的元素.请回答下列问题: ,A与C形成的10电子分子的电子式为
,A与C形成的10电子分子的电子式为 .
.