题目内容
13.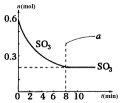 在一个2L的密闭容器中,发生反应:2SO3(g)?2SO2(g)+O2(g)-Q (Q>0),其中SO3的物质的量随时间变化如图所示,下列判断错误的是( )
在一个2L的密闭容器中,发生反应:2SO3(g)?2SO2(g)+O2(g)-Q (Q>0),其中SO3的物质的量随时间变化如图所示,下列判断错误的是( )| A. | 0~8min内v(SO3)=0.025mol/(L•min) | |
| B. | 8min时,v逆(SO2)=2v正 (O2) | |
| C. | 8min时,容器内压强保持不变 | |
| D. | 若8min时将容器压缩为1L,n(SO3)的变化如图中a |
分析 A.由图可知,8min达到平衡,△n(SO3)=0.6mol-0.2mol=0.4mol,结合v=$\frac{△c}{△t}$计算;
B.8min时达到平衡,不同物质的正逆反应速率之比等于化学计量数之比;
C.平衡时,气体的物质的量不变;
D.若8min时将容器压缩为1L,若平衡不移动,n(SO3)=0.4mol,但压强增大平衡逆向移动,可知0.4mol<n(SO3)<0.6mol.
解答 解:A.由图可知,8min达到平衡,△n(SO3)=0.6mol-0.2mol=0.4mol,0~8min内v(SO3)=$\frac{\frac{0.4mol}{2L}}{8min}$=0.025mol/(L•min),故A正确;
B.8min时达到平衡,不同物质的正逆反应速率之比等于化学计量数之比,则8min时v逆(SO2)=2v正 (O2),故B正确;
C.平衡时,气体的物质的量不变,则8min时容器内压强保持不变,故C正确;
D.若8min时将容器压缩为1L,若平衡不移动,n(SO3)=0.4mol,但压强增大平衡逆向移动,可知0.4mol<n(SO3)<0.6mol,不能从0.4mol开始增大,a变化与实际不符,故D错误;
故选D.
点评 本题考查物质的量与时间变化曲线,为高频考点,把握图中物质的量的变化、平衡特征、平衡移动为解答的关键,侧重分析与应用能力的考查,注意选项D为解答的难点,题目难度不大.

练习册系列答案
相关题目
3.有A、B、C三种主族元素,已知A元素原子的价电子构型为nsn,B元素原子的M层上有两个未成对电子,C元素原子L层的p轨道上有一对成对电子,由这三种元素组成的化合物的化学式不可能是( )
| A. | A3BC4 | B. | A2BC4 | C. | A2BC3 | D. | A4BC4 |
4. 常温下,在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )
常温下,在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )
 常温下,在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )
常温下,在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )| A. | 在0.1 mol•L-1Na2CO3溶液中:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) | |
| B. | 当溶液的pH为7时,溶液的总体积为20 mL | |
| C. | 在B点所示的溶液中,离子浓度最大的是HCO3- | |
| D. | 在A点所示的溶液中:c(CO32-)=c(HCO3-)>c(OH-)>c(H+) |
1.下列实验操作、现象和对应的实验结论均正确的是( )
| 实验操作和现象 | 实验结论 | |
| A | 检验某溶液中是否含有SO42-时,向溶液中滴加用盐 酸酸化的BaCl2溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 检验输送氯气的管道是否发生泄漏时,用一根玻璃棒蘸取浓氨水,然后靠近管道 | 有白色烟雾产生时说明管道发生泄漏 |
| C | 检验FeCl3溶液中是否含有Fe2+时,向溶液中滴加 酸性KMnO4溶液,溶液变为无色 | 该溶液中一定含有Fe2+ |
| D | 向2mL0.1mol•L-1 硝酸银溶液中加入几滴0.1mol•L-1NaCl溶液,出现白色沉淀,再加入几滴0.1mol•L-1Na2S溶液,有黑色沉淀生成 | 该现象说明相同温度下Ksp(Ag2S)<Ksp(AgCl) |
| A. | A | B. | B | C. | C | D. | D |
18.下列反应可用离子方程式“H++OH-→H2O”表示的是( )
| A. | H2SO4溶液与Ba(OH)2溶液混合 | B. | NH3•H2O溶液与HCl溶液混合 | ||
| C. | NaHCO3溶液与NaOH溶液混合 | D. | HNO3溶液与KOH溶液混合 |
5.下列叙述中,错误的是( )
| A. | 新制氯水的氧化性强于久置氯水 | |
| B. | 过量铁与Cl2反应时生成FeCl2 | |
| C. | 1molCl2与热NaOH溶液反应生成NaClO3和NaCl时,需NaOH 2mol | |
| D. | 将饱和氯水滴到淀粉碘化钾试纸上,试纸先变蓝后变白,说明氯水具有强氧化性 |
2.药物阿司匹林可由水杨酸制得,它们的结构如图所示.有关说法正确的是( )

| A. | 1 mol阿司匹林最多可消耗5 molH2 | |
| B. | 水杨酸分子中所有原子可能共面 | |
| C. | 水杨酸可以发生取代、加成、氧化、加聚反应 | |
| D. | 1 mol阿司匹林最多可消耗2 molNaOH |
 已知A、B、C、D、X、Y、Z七种短周期主族元素的原子序数依次增大,A是元素周期表中原子半径最小的,B的最高价氧化物的水化物与其氢化物反应生成盐,且B的核电荷数比Y的最外层电子数多1.C原子的最外层电子数是次外层电子数的3倍,D原子半径在同周期中除稀有气体外最大,X是同周期中简单离子半径最小的元素.请回答下列问题:
已知A、B、C、D、X、Y、Z七种短周期主族元素的原子序数依次增大,A是元素周期表中原子半径最小的,B的最高价氧化物的水化物与其氢化物反应生成盐,且B的核电荷数比Y的最外层电子数多1.C原子的最外层电子数是次外层电子数的3倍,D原子半径在同周期中除稀有气体外最大,X是同周期中简单离子半径最小的元素.请回答下列问题: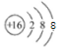 ,A与C形成的10电子分子的电子式为
,A与C形成的10电子分子的电子式为 .
.