题目内容
14.常温下,浓度均为0.1mol•L-1 的下列三种盐溶液,其pH 测定如表所示:| 序号 | ① | ② | ③ |
| 溶液 | CH3COONa | Na2CO3 | NaClO |
| pH | 8.8 | 11.6 | 10.3 |
| A. | 三种溶液中,水的电离程度①>③>② | |
| B. | Na2CO3 和NaHCO3 溶液中,粒子种类相同 | |
| C. | Na2CO3 溶液中,c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) | |
| D. | 常温下,等浓度的CH3COOH 溶液和HClO 溶液的酸性:HClO>CH3COOH |
分析 酸性越弱,其酸根离子水解程度越大,对应的盐溶液的pH越大;
A、易水解的盐能促进水的电离;
B、Na2CO3 和NaHCO3 溶液中的电离和水解平衡分析离子种类;
C、碳酸钠溶液中存在电荷守恒,阴阳离子所带总电荷数相同;
D、对应的盐溶液的pH越大,酸根离子水解程度越大,酸越弱;
解答 解:酸性越弱,其酸根离子水解程度越大,对应的盐溶液的pH越大;
A、易水解的盐能促进水的电离,水解程度越大,对水的电离的促进程度越大,则四种溶液中,水的电离程度③>②>①,故A错误;
B、碳酸钠中CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,H2O?H++OH-,碳酸氢钠溶液中HCO3-?CO32-+H+,HCO3-+H2O?H2CO3+OH-,H2O?H++OH-,所以两种溶液中粒子种类相同,故B正确;
C、Na2CO3 溶液中存在电荷守恒,c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故C错误;
D、对应的盐溶液的pH越大,酸根离子水解程度越大,酸越弱,则将等浓度的CH3COOH和HClO溶液,CH3COOH的酸性强,HClO<CH3COOH,故D错误;
故选B.
点评 本题考查了盐的水解、影响水的电离的程度的因素、物料守恒的应用等,注意根据酸性越弱,其酸根离子水解程度越大,对应的盐溶液的pH越大,题目难度中等.

练习册系列答案
相关题目
10.油条和豆浆是我国传统的早餐食物,炸油条时常用到一种白色物质,它既能中和发酵过程中产生的酸,又能起发泡作用,这种白色物质是( )
| A. | NaOH | B. | Ca(OH)2 | C. | NaHCO3 | D. | NaCl |
5.将足量的CO2不断通入NaOH、Ca(OH)2、NaAlO2的混合溶液中〔已知NaAlO2与CO2反应生成Al(OH)3〕,则生成沉淀的物质的量与通入CO2的体积的关系可表示为( )
| A. | 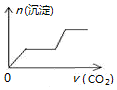 | B. | 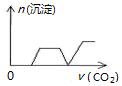 | C. | 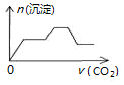 | D. |  |
9.单质铁(Fe)可将水体中的硝酸盐(NO3-)转化为铵盐(NH4+)而去除掉,现将足量铁粉投入水体中,经24小时测定NO3-的去除率和初始pH的关系如图所示,已知pH=2.5时,在铁粉的外层包裹的主要是其氧化产物NO3-(可导电),而pH=4.5时,则是不导电的 FeO(OH),下列说法不正确的是( )
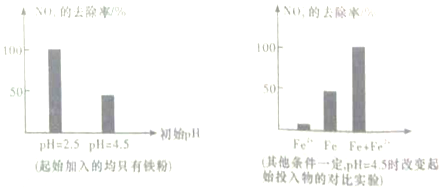

| A. | pH=4.5时,NO3-的去除率低,其原因可能是FeO(OH) 不导电,阻碍电子转移 | |
| B. | 通过对比试验发现,在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率,可能原因是Fe2+将NO3-直接还原了 | |
| C. | 加入Fe2+可能发生的反应是Fe2++2FeO(OH)═Fe3O4+2H+ | |
| D. | 由图猜测,溶液中H+浓度越大,对NO3-的去除率越高 |
19.化学与生产、生活密切相关,下列说法不正确的是( )
| A. | 铝及其合金广泛应用,是因为铝的性质稳定,不易被腐蚀 | |
| B. | 用乙烯作为水果的催熟剂,以使生水果尽快成熟 | |
| C. | 工业上燃烧煤时,加入少量石灰石是为了减少SO2的排放 | |
| D. | 误食重金属盐引起人体中毒,可喝牛奶或豆浆解毒 |
6.下列指定反应的离子方程式正确的是( )
| A. | Na2CO3溶液中CO32-水解:CO32-+2H2O?H2CO3+2OH- | |
| B. | Al溶于NaOH溶液:Al+2OH-═AlO2-+H2↑ | |
| C. | Fe3O4溶于稀HNO3:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O | |
| D. | 向Ba(OH)2溶液中加少量稀H2SO4:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
3.下列说法正确的是( )
| A. | 石油的裂解、煤的干馏、蛋白质的盐析都是化学变化 | |
| B. | C2H4Cl2、C5H12均只有两种同分异构体 | |
| C. | Na与H2O的反应是熵增的放热反应,该反应能自发进行 | |
| D. | 已知25℃、101kPa,在稀溶液中:H+ (aq)+OH-(aq)=H2O(aq)△H=-57.3kJ/mol.则相同条件下,若将含1molCH3COOH的稀溶液与含1molNaOH的稀溶液混合,放出的热量等于57.3kJ |
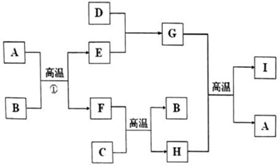 有关物质的转化关系如图所示(部分物质与条件己略去).A是最常见的无色液体,B、C是常见的金属单质,D、E是气体单质,且D在空气中的含量最多,F 是一种具有磁性的化合物,H是既能与强酸反应又能与强碱反应的氧化物:I具有耐高温、抗冲击、导热性好的优良性质,广泛应用于电子工业、陶瓷工业中.
有关物质的转化关系如图所示(部分物质与条件己略去).A是最常见的无色液体,B、C是常见的金属单质,D、E是气体单质,且D在空气中的含量最多,F 是一种具有磁性的化合物,H是既能与强酸反应又能与强碱反应的氧化物:I具有耐高温、抗冲击、导热性好的优良性质,广泛应用于电子工业、陶瓷工业中. .
.