题目内容
5.将足量的CO2不断通入NaOH、Ca(OH)2、NaAlO2的混合溶液中〔已知NaAlO2与CO2反应生成Al(OH)3〕,则生成沉淀的物质的量与通入CO2的体积的关系可表示为( )| A. | 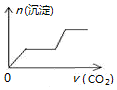 | B. | 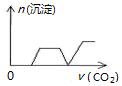 | C. | 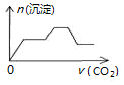 | D. |  |
分析 向NaOH、Ca(OH)2、NaAlO2的混合溶液中通入CO2,立刻就有沉淀CaCO3产生;将Ca(OH)2消耗完毕,接下来消耗NaOH,因而此段不会产生沉淀(即沉淀的量保持不变);NaOH被消耗完毕,接下来又因二氧化碳足量,还可以继续与上面反应的产物Na2CO3、CaCO3反应,最后剩余沉淀为Al(OH)3,据此进行解答.
解答 解:混合液中通入CO2,依次发生反应为:CO2+Ca(OH)2═CaCO3↓+H2O、CO2+2NaOH═Na2CO3+H2O、CO2+3H2O+2NaAlO2═2Al(OH)3↓+Na2CO3、CO2+H2O+Na2CO3═2NaHCO3,CaCO3+CO2+H2O=Ca(HCO3)2,则图象中开始就有碳酸钙沉淀生成,之后沉淀的量不变,氢氧化钠完全反应后开始生成氢氧化铝沉淀,此段沉淀的量又增大;当偏铝酸钠完全反应后,Na2CO3、CaCO3分别与二氧化碳反应,
由以上分析可知,满足该变化的图象为C,
故选C.
点评 本题考查元素化合物知识、离子反应的应用,侧重于二氧化碳通入混合溶液中的反应顺序的考查,注重运用基本知识解决新问题的能力,并且要考虑二氧化碳的充足会使生成物继续反应的问题.难度不大.

练习册系列答案
相关题目
1.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 mol NO中含有的原子数目为2NA | |
| B. | 常温下,22.4L氮气含有的原子数目为2NA | |
| C. | 1L1 mol L-1 MgS04溶液中含有的Mg2+数目为2NA | |
| D. | 2.8 g硅单质与足量氧气在高温下完全反应时,硅原子失去的电子数目为2NA |
2.二甲醚和乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列鉴别方法中能对二者进行鉴别的是( )
①质谱法
②红外光谱法
③核磁共振氢谱
④李比希燃烧法
⑤元素分析仪.
①质谱法
②红外光谱法
③核磁共振氢谱
④李比希燃烧法
⑤元素分析仪.
| A. | ①② | B. | ④⑤ | C. | ②③ | D. | ③④ |
19.下列有关实验的说法正确的是( )
| A. | 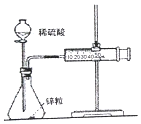 图中测定锌粒与1 mol•L-1 稀硫酸的反应速率,只需测定注射器中收集氢气的体积 | |
| B. | 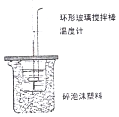 图 装置中进行50 mL 0.50 mol•L-1盐酸与50 mL 0.55 mol•L-1 NaOH 溶液发生中和反应放出热量的测定,使温度计温度升高的热量就是中和反应生成1 mol 水的热量 | |
| C. | 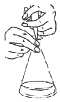 图 酸碱中和滴定中,可以在滴定过程中用少量水冲洗锥形瓶内壁 | |
| D. | 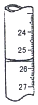 图滴定管中液面位置如图所示,则此时的读数为26.50 mL |
10.一定条件下,容积为 1L 的密闭容器中发生反应:SiF4(g)+2H2O(g)?SiO2(s)+4HF(g).下列各项中不能说明该反应已达化学平衡状态的是( )
| A. | v(SiF4)消耗=4v(HF)生成 | B. | HF 的体积分数不再变化 | ||
| C. | 容器内气体压强不再变化 | D. | 容器内气体总质量不再变化 |
17.常温下,下列各组离子在指定溶液中可能大量共存的是( )
| A. | FeCl3溶液中:K+、Na+、SO42-、OH- | |
| B. | 使酚酞试液变红的溶液中:NH4+、Na+、HCO3-、NO3- | |
| C. | 漂白粉溶液中:H+、Na+、I-、Cl- | |
| D. | 与铝反应产生氢气的溶液中:Na+、K+、CO32-、OH- |
14.常温下,浓度均为0.1mol•L-1 的下列三种盐溶液,其pH 测定如表所示:
下列说法正确的是( )
| 序号 | ① | ② | ③ |
| 溶液 | CH3COONa | Na2CO3 | NaClO |
| pH | 8.8 | 11.6 | 10.3 |
| A. | 三种溶液中,水的电离程度①>③>② | |
| B. | Na2CO3 和NaHCO3 溶液中,粒子种类相同 | |
| C. | Na2CO3 溶液中,c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) | |
| D. | 常温下,等浓度的CH3COOH 溶液和HClO 溶液的酸性:HClO>CH3COOH |
15.装置甲、乙、丙中分别盛有空气、水、空气,两个燃烧匙中物质足量,燃烧完全后,打开止水夹,水倒吸到丙装置中.则燃烧匙a、b中盛有的物质分別是( )
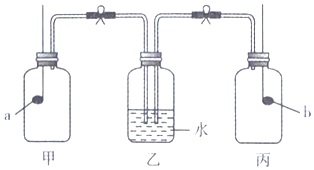

| A. | a为红磷,b为钠 | B. | a为硫,b为木炭 | C. | a为钠,b为红硫 | D. | a为木炭,b为磷 |
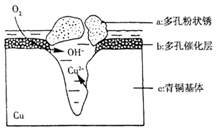 如图为青铜器在潮湿环境中发生的电化学腐蚀的示意图.
如图为青铜器在潮湿环境中发生的电化学腐蚀的示意图.