题目内容
1.用已知浓度的烧碱溶液滴定未知浓度的盐酸.①滴定时,选用酚酞作指示剂,判断滴定达终点的现象为当滴入最后一滴氢氧化钠溶液时,溶液恰好由无色变为浅红色且半分钟后不褪色;
②下列操作会使所测得的盐酸的浓度偏低的是CD.
A.盛装待测液的锥形瓶用水洗后未干燥
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失
C.酸式滴定管用蒸馏水洗净后,直接装液
D.读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数.
分析 ①选用酚酞作指示剂,酚酞遇到氢氧化钠显示红色,遇到盐酸显示无色,据试验原理来判断终点;
②根据c(待测)=$\frac{c标准×V标准}{V待测}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:(1)①用已知浓度的烧碱溶液滴定未知浓度的盐酸滴定时,选用酚酞作指示剂,当滴入最后一滴氢氧化钠溶液时,溶液恰好由无色变为浅红色且半分钟后不褪色,故答案为:当滴入最后一滴氢氧化钠溶液时,溶液恰好由无色变为浅红色且半分钟后不褪色;
②A.盛装待测液的锥形瓶用水洗后未干燥,不影响待测液的物质的量,所以该情况不影响结果,故错误;
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失,则标准液的体积偏大,结果偏大,故错误;
C.酸式滴定管用蒸馏水洗净后,直接装液,相当于将酸稀释,所以碱的体积偏小,测出的浓度偏小,故正确;
D.读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数,所以消耗碱的体积偏小,测出的浓度偏小,故正确;
故选CD.
点评 本题主要考查了中和滴定操作的误差分析,根据c(待测)=$\frac{c标准×V标准}{V待测}$分析是解答的关键,题目难度不大.

练习册系列答案
相关题目
9.在2L含有物质的量均为0.1mol的Ca2+、Mg2+的某溶液中,加入一定量的NaOH固体使溶液的pH=ll.有沉淀生成,过滤.已知:KSP[Ca(OH)2]=4.68×10-6;KSP[Mg(OH)2]=5.61×10-12.当离子浓度小于10-5mol•L-1认为已经除净,下列说法正确的是( )
| A. | 此沉淀是Mg(OH)2、Ca(OH)2的混合物 | |
| B. | 此沉淀只有Mg(OH)2 | |
| C. | 过滤后滤液中存在Ca2+、Mg2+ | |
| D. | 向原溶液中加入8.8 g NaOH固体,不可以使Ca2+部分转化为沉淀 |
16.实验室用标准盐酸测定NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是( )
| A. | 酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次 | |
| B. | 开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 | |
| C. | 盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次 | |
| D. | 锥形瓶内溶液颜色由黄色变橙色,立即记下滴定管内液面所在刻度 |
13.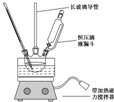 硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下:
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下:
①配制混酸:组装如图反应装置.取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混和酸,加入漏斗中,把18mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀.
③在50~60℃下发生反应,直至反应结束.
④除去混和酸后,粗产品依次用蒸馏水和100ml 0.1mol/L的Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.
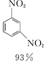
已知(1) +HNO3(浓)$\frac{50~60℃}{98%浓{H}_{2}S{O}_{4}}$+
+HNO3(浓)$\frac{50~60℃}{98%浓{H}_{2}S{O}_{4}}$+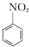 +H2O
+H2O
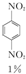
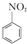 +HNO3(浓)$\frac{95%}{98%浓{H}_{2}S{O}_{4}}$
+HNO3(浓)$\frac{95%}{98%浓{H}_{2}S{O}_{4}}$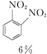 +
+ +
+
(2)可能用到的有关数据如表
请回答下列问题:
(1)配制混酸应在烧杯中先加入浓硝酸.
(2)恒压滴液漏斗的优点是可以保持漏斗内压强与发生器内压强相等,使漏斗内液体能顺利流下.
(3)实验装置中长玻璃管可用冷凝管(球形冷凝管或直行冷凝管均可)代替(填仪器名称).
(4)反应温度控制在50~60℃的原因是防止副反应发生.
(5)反应结束后产品在液体的下层(填“上”或者“下”),分离混酸和产品的操作方法为分液.
(6)实验前要配制100ml 0.1mol/L的Na2CO3溶液,需要用到的玻璃仪器有玻璃棒、100ml容量瓶、胶头滴管、烧杯 用Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净?取最后一次洗涤液,向溶液中加入氯化钙,无沉淀生成,说明已洗净.
(7)为了得到更纯净的硝基苯,还须先向液体中加入氯化钙除去水,然后蒸馏.
 硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下:
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下:①配制混酸:组装如图反应装置.取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混和酸,加入漏斗中,把18mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀.
③在50~60℃下发生反应,直至反应结束.
④除去混和酸后,粗产品依次用蒸馏水和100ml 0.1mol/L的Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.
已知(1)
 +HNO3(浓)$\frac{50~60℃}{98%浓{H}_{2}S{O}_{4}}$+
+HNO3(浓)$\frac{50~60℃}{98%浓{H}_{2}S{O}_{4}}$+ +H2O
+H2O +HNO3(浓)$\frac{95%}{98%浓{H}_{2}S{O}_{4}}$
+HNO3(浓)$\frac{95%}{98%浓{H}_{2}S{O}_{4}}$ +
+ +
+
(2)可能用到的有关数据如表
| 物质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 1,3二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | - | 83 | 1.4 | 易溶于水 |
| 浓硫酸 | - | 338 | 1.84 | 易溶于水 |
(1)配制混酸应在烧杯中先加入浓硝酸.
(2)恒压滴液漏斗的优点是可以保持漏斗内压强与发生器内压强相等,使漏斗内液体能顺利流下.
(3)实验装置中长玻璃管可用冷凝管(球形冷凝管或直行冷凝管均可)代替(填仪器名称).
(4)反应温度控制在50~60℃的原因是防止副反应发生.
(5)反应结束后产品在液体的下层(填“上”或者“下”),分离混酸和产品的操作方法为分液.
(6)实验前要配制100ml 0.1mol/L的Na2CO3溶液,需要用到的玻璃仪器有玻璃棒、100ml容量瓶、胶头滴管、烧杯 用Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净?取最后一次洗涤液,向溶液中加入氯化钙,无沉淀生成,说明已洗净.
(7)为了得到更纯净的硝基苯,还须先向液体中加入氯化钙除去水,然后蒸馏.
10. 用1-丁醇、溴化钠和较浓H2SO4混合物为原料,在实验室制备1-溴丁烷,并检验反应的部分副产物.(已知:NaCl+H2SO4(浓)=NaHSO4+HCl↑)现设计如下装置,其中夹持仪器、加热仪器及冷却水管没有画出.请回答下列问题:
用1-丁醇、溴化钠和较浓H2SO4混合物为原料,在实验室制备1-溴丁烷,并检验反应的部分副产物.(已知:NaCl+H2SO4(浓)=NaHSO4+HCl↑)现设计如下装置,其中夹持仪器、加热仪器及冷却水管没有画出.请回答下列问题:
(1)仪器A的名称是三颈烧瓶.
(2)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷.写出该反应的化学方程式CH3CH2CH2CH2OH+NaBr+H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$CH3CH2CH2CH2Br+NaHSO4+H2O.
(3)理论上,上述反应的生成物还可能有:丁醚、1-丁烯、溴化氢等.熄灭A处酒精灯,在竖直冷凝管上方塞上塞子,打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物.B、C中应盛放的试剂分别是硝酸银、高锰酸钾溶液或溴水.
(4)在实验过程中,发现A中液体由无色逐渐变成黑色,该黑色物质与浓硫酸反应的化学方程式为C+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,可在竖直冷凝管的上端连接一个内装吸收剂碱石灰的干燥管,以免污染空气.
(5)相关有机物的数据如下:
为了进一步精制1-溴丁烷,继续进行了如下实验:待烧瓶冷却后,拔去竖直的冷凝管,塞上带温度计的橡皮塞,关闭a,打开b,接通冷凝管的冷凝水,使冷水从d(填c或d)处流入,迅速升高温度至101.6℃,收集所得馏分.
(6)若实验中所取1-丁醇、NaBr分别为7.4g、13.0g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6g 1-溴丁烷,则1-溴丁烷的产率是70%.
 用1-丁醇、溴化钠和较浓H2SO4混合物为原料,在实验室制备1-溴丁烷,并检验反应的部分副产物.(已知:NaCl+H2SO4(浓)=NaHSO4+HCl↑)现设计如下装置,其中夹持仪器、加热仪器及冷却水管没有画出.请回答下列问题:
用1-丁醇、溴化钠和较浓H2SO4混合物为原料,在实验室制备1-溴丁烷,并检验反应的部分副产物.(已知:NaCl+H2SO4(浓)=NaHSO4+HCl↑)现设计如下装置,其中夹持仪器、加热仪器及冷却水管没有画出.请回答下列问题:(1)仪器A的名称是三颈烧瓶.
(2)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷.写出该反应的化学方程式CH3CH2CH2CH2OH+NaBr+H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$CH3CH2CH2CH2Br+NaHSO4+H2O.
(3)理论上,上述反应的生成物还可能有:丁醚、1-丁烯、溴化氢等.熄灭A处酒精灯,在竖直冷凝管上方塞上塞子,打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物.B、C中应盛放的试剂分别是硝酸银、高锰酸钾溶液或溴水.
(4)在实验过程中,发现A中液体由无色逐渐变成黑色,该黑色物质与浓硫酸反应的化学方程式为C+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,可在竖直冷凝管的上端连接一个内装吸收剂碱石灰的干燥管,以免污染空气.
(5)相关有机物的数据如下:
| 物质 | 熔点/0C | 沸点/0C |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
(6)若实验中所取1-丁醇、NaBr分别为7.4g、13.0g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6g 1-溴丁烷,则1-溴丁烷的产率是70%.
 根据要求回答下列问题:
根据要求回答下列问题:
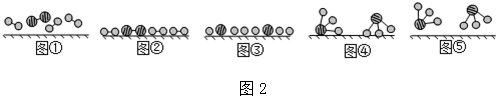
 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面,N2、H2中化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面,N2、H2中化学键断裂.