题目内容
14.下列有关仪器的使用方法或实验操作正确的是( )| A. | 实验室配制一定物质的量浓度NaCl溶液,用托盘天平秤取5.85gNaCl | |
| B. | 用容量瓶配制溶液时先将容量瓶洗涤并烘干 | |
| C. | 向试管中滴加液体时,胶头滴管紧贴试管内壁 | |
| D. | 酸碱滴定时当指示剂变色后保持半分钟内不变色即达滴定终点 |
分析 A.托盘天平的最小读数为0.1g,无法称量5.85g氯化钠;
B.容量瓶不需要干燥,只要洗涤干净即可;
C.胶头滴管的下端不能与试管内壁接触;
D.干净中和滴定操作中判断滴定终点的方法判断.
解答 解:A.实验室配制一定物质的量浓度NaCl溶液,由于托盘天平的最小读数为0.1g,则无法用托盘天平秤取5.85gNaCl,故A错误;
B.容量瓶配制溶液时需要将容量瓶洗涤干净,不需要烘干,故B错误;
C.向试管中滴加液体时,胶头滴管不能与试管内壁接触,否则会污染试剂,故C错误;
D.酸碱滴定时,当指示剂变色后且保持半分钟内不变色,即可荣威已经达到滴定终点,故D正确;
故选D.
点评 本题考查了常见仪器的构造及使用方法,题目难度不大,明确常见仪器的构造及正确使用方法为解答关键,注意掌握常见计量仪器的最小读数情况,为易错点,试题培养了学生的化学实验能力.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
13.豆类中的香豆雌酚是一种植物雌性激素,其结构式如图所示,下列有关说法正确的是( )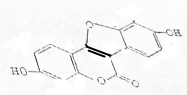

| A. | 该物质的分子式为C15H10O5 | |
| B. | 该物质中所有原子一定在同一平面内 | |
| C. | 1mol该物质最多可与5molBr2发生反应 | |
| D. | 1mol该物质最多可与3molNaOH发生反应 |
5.下列事实不能证明HNO2是弱酸的是( )
| A. | 向HNO2溶液中加入NaNO2固体,pH变大 | |
| B. | 用HNO2溶液做导电性实验,灯泡很暗 | |
| C. | 0.1mol•L-1的HNO2溶液的pH=2 | |
| D. | pH=3的HNO2溶液稀释至100倍后,3<pH<5 |
9. I.下表是A、B、C、D、E五种短周期元素的某些性质:
I.下表是A、B、C、D、E五种短周期元素的某些性质:
(1)E原子的外围电子排布式为2s22p5.
(2)与AD2互为等电子体的分子化学式为N2O(写出一种).
(3)BD2分子中B原子的杂化方式为sp2杂化,分子的立体构型为V形.
Ⅱ.下表是部分金属元素的电离能.
(4)已知X、Y、Z的价层电子构型为ns1,则三种金属的氯化物( RCl)的熔点由低到高的顺序为ZCl<YCl<XCl.
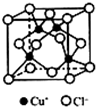
(5)氯化亚铜常用作有机合成催化剂,并用于颜料,防腐等工业.氯化亚铜的晶体结构如图所示.与同一个Cl-相连的Cu+有4个.若晶胞的边长为a cm,则该品体的密度为$\frac{398}{{N}_{A}×{a}^{3}}$g•cm-3.(设NA为阿伏加德罗常数的值)
 I.下表是A、B、C、D、E五种短周期元素的某些性质:
I.下表是A、B、C、D、E五种短周期元素的某些性质:| A | B | C | D | E | |
| 化合价 | -4 | -2 | -1 | -2 | -1 |
| 电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
(2)与AD2互为等电子体的分子化学式为N2O(写出一种).
(3)BD2分子中B原子的杂化方式为sp2杂化,分子的立体构型为V形.
Ⅱ.下表是部分金属元素的电离能.
| X | Y | Z | |
| 第一电离能/(kJ/mol) | 520.2 | 495.8 | 418.8 |
(5)氯化亚铜常用作有机合成催化剂,并用于颜料,防腐等工业.氯化亚铜的晶体结构如图所示.与同一个Cl-相连的Cu+有4个.若晶胞的边长为a cm,则该品体的密度为$\frac{398}{{N}_{A}×{a}^{3}}$g•cm-3.(设NA为阿伏加德罗常数的值)
19.如图所示的实验操作错误的是( )
| A. |  | B. |  | C. |  | D. |  |
3.下列叙述正确的是( )
| A. | 合成氨工业中,移走NH3可增大正反应速率,提高原料转化率 | |
| B. | 酸碱中和滴定时,锥形瓶需用待测液润洗2~3次,再加入待测液 | |
| C. | 将NO2、N2O4混合气体的体积压缩为原来的一半,则气体颜色加深 | |
| D. | 电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等 |