题目内容
16.某温度下将Cl2通入KOH溶液中,反应后得到KCl、KClO、KClO3的混合溶液,这三种产物的物质的量之比不可能为( )| A. | 2:1:1 | B. | 6:1:1 | C. | 10:5:1 | D. | 15:5:2 |
分析 根据得失电子守恒分析可得:n(KCl)=n(KClO)+5n(KClO3),代入检验,即可得出结论,由此分析解答.
解答 解:A、2≠1+1×5,不符合,故A错误;
B、6=1+1×5,符合,故B正确;
C、10=5+1×5,符合,故C正确;
D、15=5+2×5,符合,故D正确;
故选A.
点评 本题考查氧化还原反应的计算,题目难度不大,本题注意从氧化还原反应中氧化剂和还原剂之间得失电子数目相等的角度计算,注意守恒法的利用.

练习册系列答案
相关题目
6.金属钠因保管不慎造成火灾,扑灭燃着的金属钠可用( )
| A. | 水 | B. | 泡沫灭火器 | C. | 黄沙 | D. | 煤油 |
4.某气体的摩尔质量为Mg•mol-1,NA表示阿伏加德罗常数的值,在一定的温度和压强下,体积为VL的该气体所含有的分子数为X.则$\frac{MX}{VNA}$表示的是( )
| A. | VL该气体的质量(以g为单位) | B. | 1L该气体中所含的分子数 | ||
| C. | 1mol该气体的体积(以L为单位) | D. | 1L该气体的质量(以g为单位) |
11. 用如图所示装置进行下列实验:将①中溶液滴入②中.预测的现象与结论相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中.预测的现象与结论相符的是( )
 用如图所示装置进行下列实验:将①中溶液滴入②中.预测的现象与结论相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中.预测的现象与结论相符的是( )| 选项 | ① | ② | 预测②中现象 | 实验结论 |
| A | 浓硫酸 | 浓盐酸 | 产生大量气体 | 硫酸的酸性比盐酸强 |
| B | 浓硫酸 | 铜片 | 铜片溶解,产生气泡,底部产生灰白色粉末 | 浓硫酸的酸性和强氧化性 |
| C | 浓硫酸 | CuSO4•5H2O | 固体由蓝色变为白色 | 浓硫酸具有吸水性,发生物理变化 |
| D | 浓硫酸 | 蔗糖 | 固体由白色变为黑色海绵状,并有刺激性气体放出 | 浓硫酸具有脱水性、氧化性 |
| A. | A | B. | B | C. | C | D. | D |
4.某探究小组废弃的印刷线路板(含Cu、Al少量Au、Pt等金属的混合物回收Cu并制备硫酸铝晶体[Al2(SO4)3•18H2O],设计路线如下:
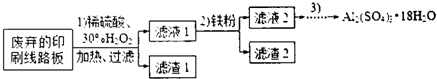
(1)过滤时所需要的玻璃仪器有玻璃棒、漏斗、烧杯.
(2)实验时需对滤渣2进行洗涤,判断洗涤是否干净的实验操作方法是取最后一次的洗涤液,加入氯化钡溶液和稀盐酸无白色沉淀出现,说明洗涤干净.
(3)为确定加入铁粉的量,实验中需测定滤液1中Cu2+的量.实验操作为:除去H2O2;准确量取一定体积滤液1于带塞锥形瓶中,加水稀释,调节溶液pH=3-4,加入过量KI-淀粉溶液,用Na2S2O3标准溶液滴定至终点.上述过程中反应的离子方程式:
2Cu2++4I-=2CuI+I2
I2+2S2O32-=2I-+S4O62-
①滴定管在注入Na2S2O3标准溶液之前,要先用蒸馏水洗净,再用Na2S2O3标准溶液润洗2~3次.
②滴定终点观察到的现象为溶液蓝色恰好褪去,且半分钟内不恢复.
③若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会偏高(填“偏高”、“偏低”或“不变”)
(4)由滤液2制取硫酸铝晶体,探究小组设计了如下二种方案:
甲:滤液2$→_{过滤}^{适量Al粉}$滤液$\stackrel{操作3}{→}$Al2(SO4)3•18H2O
乙:滤液2$→_{过滤}^{NaOH溶液}$滤液$\stackrel{H_{2}SO_{4}}{→}$溶液$\stackrel{操作3}{→}$Al2(SO4)3•18H2O
①操作③的实验步骤依次为:蒸发浓缩:冷却结晶、过滤、洗涤.
②从原子利用率角度考虑,甲方案更合理.(填“甲”或“乙”)
(5)他们查阅了资料,认为通过先氧化、再调节溶液pH也可将滤液2中的Fe2+除去.下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mo1•L-1计算).
①氧化需加入H2O2而不用Cl2的原因是不引入杂质,对环境无污染.
②调节溶液pH约为3.2~3.8.

(1)过滤时所需要的玻璃仪器有玻璃棒、漏斗、烧杯.
(2)实验时需对滤渣2进行洗涤,判断洗涤是否干净的实验操作方法是取最后一次的洗涤液,加入氯化钡溶液和稀盐酸无白色沉淀出现,说明洗涤干净.
(3)为确定加入铁粉的量,实验中需测定滤液1中Cu2+的量.实验操作为:除去H2O2;准确量取一定体积滤液1于带塞锥形瓶中,加水稀释,调节溶液pH=3-4,加入过量KI-淀粉溶液,用Na2S2O3标准溶液滴定至终点.上述过程中反应的离子方程式:
2Cu2++4I-=2CuI+I2
I2+2S2O32-=2I-+S4O62-
①滴定管在注入Na2S2O3标准溶液之前,要先用蒸馏水洗净,再用Na2S2O3标准溶液润洗2~3次.
②滴定终点观察到的现象为溶液蓝色恰好褪去,且半分钟内不恢复.
③若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会偏高(填“偏高”、“偏低”或“不变”)
(4)由滤液2制取硫酸铝晶体,探究小组设计了如下二种方案:
甲:滤液2$→_{过滤}^{适量Al粉}$滤液$\stackrel{操作3}{→}$Al2(SO4)3•18H2O
乙:滤液2$→_{过滤}^{NaOH溶液}$滤液$\stackrel{H_{2}SO_{4}}{→}$溶液$\stackrel{操作3}{→}$Al2(SO4)3•18H2O
①操作③的实验步骤依次为:蒸发浓缩:冷却结晶、过滤、洗涤.
②从原子利用率角度考虑,甲方案更合理.(填“甲”或“乙”)
(5)他们查阅了资料,认为通过先氧化、再调节溶液pH也可将滤液2中的Fe2+除去.下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mo1•L-1计算).
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| A13+ | 3.8 | 5.2 |
②调节溶液pH约为3.2~3.8.
1.2SO2(g)+O2(g)?2SO3(g)是制备硫酸的重要反应.下列叙述正确的是( )
| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 增大反应体系的压强,反应速率一定增大 | |
| C. | 该反应是放热反应,降低温度正反应速率加快 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=$\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$ |
2. 图
图 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色,为实现铁上镀锌,接通
上的c点显红色,为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述正确的是( )
后,使c、d两点短路.下列叙述正确的是( )
 图
图 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色,为实现铁上镀锌,接通
上的c点显红色,为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述正确的是( )
后,使c、d两点短路.下列叙述正确的是( )| A. | a为直流电源的负极 | B. | f电极为锌板 | ||
| C. | e极发生还原反应 | D. | c极发生的反应为2 H++2e-=H2↑ |