题目内容
7.可降解高分子化合物M的一种合成路线如图所示:
已知:①芳香烃A的相对分子质量为92;
②1个C原子上连接两个-OH不稳定,易脱水形成醛基或羰基;
③-CHO$\stackrel{HCN}{→}$
 $\stackrel{H_{2}O/H+}{→}$
$\stackrel{H_{2}O/H+}{→}$
④
 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$ (-NH2易被氧化)
(-NH2易被氧化)请回答:
(1)A的化学名称为:甲苯.G的结构简式为:
 .
.(2)A→B、D→E 的反应类型分别为取代反应、加成反应.
(3)试剂Y为Fe/HCl.F的核磁共振氢谱中有5种吸收峰.
(4)C→D的反应方程式为
 .
.(5)同时满足下列条件的H的同分异构体有10种,写出任意一种的结构简式

①苯环上连接-NO2;②能发生银镜反应;③苯环上有三个取代基.
(6)参照上述合成路线和相关信息,设计一条由乙醇为起始原料制备聚乳酸
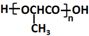 的合成路线:
的合成路线: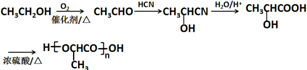 .(无机试剂任选)合成路线示例:CH≡CH$→_{催化剂/△}^{H_{2}}$CH2=CH2$→_{催化剂/△}^{HCl}$CH3CH2Cl.
.(无机试剂任选)合成路线示例:CH≡CH$→_{催化剂/△}^{H_{2}}$CH2=CH2$→_{催化剂/△}^{HCl}$CH3CH2Cl.
分析 由E结构简式结合信息③可知D为 ,F为
,F为 ,则C为
,则C为 ,B为
,B为 ,A为
,A为 ,相对分子质量为92,由M可知H为
,相对分子质量为92,由M可知H为 ,则G为
,则G为 ,结合对应物质的性质以及题目要求解答该题.
,结合对应物质的性质以及题目要求解答该题.
解答 解:由E结构简式结合信息③可知D为 ,F为
,F为 ,则C为
,则C为 ,B为
,B为 ,A为
,A为 ,相对分子质量为92,由M可知H为
,相对分子质量为92,由M可知H为 ,则G为
,则G为 ,
,
(1)由以上分析可知A为甲苯,G为 ,故答案为:甲苯;
,故答案为:甲苯; ;
;
(2)A→B发生取代反应,D→E 发生加成反应,故答案为:取代反应;加成反应;
(3)G发生还原反应生成H,由信息可知试剂Y为Fe/HCl,F为 ,含有5种H原子,则有5种吸收峰,故答案为:Fe/HCl;5;
,含有5种H原子,则有5种吸收峰,故答案为:Fe/HCl;5;
(4)C为 ,D为
,D为 ,C→D的反应方程式为
,C→D的反应方程式为 ,
,
故答案为: ;
;
(5)H为 ,对应的同分异构体①苯环上连接-NO2;②能发生银镜反应;③苯环上有三个取代基,可为
,对应的同分异构体①苯环上连接-NO2;②能发生银镜反应;③苯环上有三个取代基,可为 ,共10种,
,共10种,
故答案为:10; ;
;
(6)由乙醇为起始原料制备聚乳酸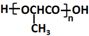 ,乙醇先氧化生成乙醛,乙醛与HCN发生加成反应,然后水解生成乳酸,发生加聚反应可生成聚乳酸,流程为
,乙醇先氧化生成乙醛,乙醛与HCN发生加成反应,然后水解生成乳酸,发生加聚反应可生成聚乳酸,流程为 ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成,为高频考点,侧重于学生的分析能力的考查,需要学生对给予反应信息利用,较好的考查学生的自学、阅读能力,是热点题型,E的结构是解题的关键,注意利用的E结构以及题给信息,利用顺推法、逆推法结合进行推断,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.当氢氧化钙固体在水中达到溶解平衡时,为使Ca(OH)2固体的量减少,需加入少量的( )
| A. | NH4NO3固体 | B. | NaOH固体 | C. | CaCl2固体 | D. | NaHSO4固体 |
15.把15g铁和氧化铁的混合物加入到150ml稀硫酸中,产生标况下氢气1.68L.待铁和氧化铁全部反应完毕后,向溶液中加入少量的硫氰化钾溶液,无明显现象.为中和过量硫酸,并使硫酸亚铁全部转化为氢氧化亚铁沉淀,用去3mol/L氢氧化钠溶液200ml.则该稀硫酸的物质的量浓度为( )
| A. | 115mol/L | B. | 1mol/L | C. | 3mol/L | D. | 2mol/L |
2.一定温度下,可逆反应2NO2?2NO+O2在体积固定的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2,同时生成2n mol NO2
②混合气体的压强不再改变
③混合气体的平均相对分子质量不再改变
④单位时间内生成n mol O2,同时生成2n mol NO
⑤混合气体的颜色不再改变
⑥用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1.
①单位时间内生成n mol O2,同时生成2n mol NO2
②混合气体的压强不再改变
③混合气体的平均相对分子质量不再改变
④单位时间内生成n mol O2,同时生成2n mol NO
⑤混合气体的颜色不再改变
⑥用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1.
| A. | ①④⑤⑥ | B. | ①②③⑤ | C. | ②③④⑥ | D. | 以上全部 |
16.下列物质分类正确的是( )
| A. | BaSO4难溶于水,属于非电解质 | |
| B. | SO2能与碱反应生成盐和水,属于酸性氧化物 | |
| C. | NH4Cl组成中不含金属离子,不属于盐 | |
| D. | NaHSO4能电离出H+,NaHSO4属于盐 |
17.NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,17g甲基(-14CH3)所含的中子数为9NA | |
| B. | 10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8% | |
| C. | 热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1300 kJ•mol-1,有 NA个水分子生成且为 液体时,吸收1300 kJ的能量 | |
| D. | 在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移2 NA个电子 |
 ,B中所含的化学键有离子键、共价键.又知X溶液显碱性,其原因是(用离子方程式表示)ClO-+H2O?HClO+OH-.
,B中所含的化学键有离子键、共价键.又知X溶液显碱性,其原因是(用离子方程式表示)ClO-+H2O?HClO+OH-.