题目内容
12.亚硝酸(HNO2)是一种与醋酸酸性相当的弱酸,很不稳定,在室温下立即分解.(1)写出HNO2的电离方程式HNO2?H++NO2-.
(2)在酸性条件下,NaNO2与KI按物质的量1﹕1恰好完全反应,I-被氧化为I2,写出该反应的离子方程式4H++2NO2-+2I-=I2+2NO↑+2H2O.
(3)要得到稳定HNO2溶液,可以往冷冻的浓NaNO2溶液中加入或通入某种物质,下列物质适合使用是a(填序号).a.稀硫酸 b.二氧化碳 c.二氧化硫
写出该反应的化学方程式2NaNO2+H2SO4=Na2SO4+2HNO2.
(4)建筑工业盐(NaNO2)与食盐外观很相似,溶液也都是无色,鉴别它们时,可将两种盐溶液分别加入酸性K2Cr2O7溶液中,加食盐水的无明显现象,加建筑工业盐溶液的溶液由橙色变为绿色(Cr3+的颜色),无气体放出,完成该反应的离子方程式8H++3NO2-+Cr2O72-=2Cr3++3NO3-+4H2O.
(5)若改用电解法将废水中NO2-转换为N2除去,N2将在阴极(填电极名称)生成.
(6)若工业废水中的NO2-的浓度约为1.0×10-6 mol•L-1,取工业废水5mL于试管中,滴加1滴0.1mol•L-1的硝酸银溶液(1滴为0.05mL),能否看到沉淀?(假设溶液体积始终为5mL,通过计算说明).(已知Ksp(AgNO2)=2×10-8mol2•L-2)
分析 (1)亚硝酸是弱电解质,在水溶液里只有部分电离;
(2)酸性条件下,亚硝酸根离子和碘离子发生氧化还原反应,碘离子被氧化生成碘单质,亚硝酸根离子得电子被还原生成一氧化氮;
(3)根据强酸制取弱酸分析,亚硝酸具有强氧化性,能氧化具有还原性的物质;
(4)亚硝酸根离子与CrO72-酸性溶液发生氧化反应生成硝酸根离子、铬离子和水;
(5)若改用电解法将废水中NO2-转换为N2除去,氮元素的化合价降低,发生还原反应在电解池的阴极;
(6)根据难溶电解质的溶度积常数表达式进行计算.
解答 解:(1)亚硝酸是弱电解质,在水溶液里只有部分电离,所以其电离方程式为HNO2?H++NO2-,
故答案为:HNO2?H++NO2-;
(2)碘离子被氧化为碘单质时,所有的碘元素化合价升高了2价,消耗碘离子是2mol,亚硝酸钠中氮元素化合价是+3价,2mol的亚硝酸钠得到2mol电子时,则需氮元素的化合价降为+2价,所以产物中含氮的物质为NO,反应的离子方程式为:4H++2NO2-+2I-=I2+2NO↑+2H2O,故答案为:4H++2NO2-+2I-=I2+2NO↑+2H2O;
(3)浓NaNO2溶液中通入二氧化碳,会发生反应生成碳酸钠,在酸性条件下会发生化学反应;
如果通入二氧化硫,会被亚硝酸氧化为硫酸,即二氧化硫具有还原性,亚硝酸具有氧化性导致,所以选用稀硫酸,反应的方程式为:2NaNO2+H2SO4=Na2SO4+2HNO2,故选:a;2NaNO2+H2SO4=Na2SO4+2HNO2;
(4)酸性条件下,亚硝酸根离子与CrO72-发生氧化反应生成硝酸根离子、铬离子和水,离子反应方程式为Cr2O72-+3NO2-+8H+=3NO3-+2Cr3++4H2O,
故答案为:Cr2O72-+3NO2-+8H+=3NO3-+2Cr3++4H2O;
(5)若改用电解法将废水中NO2-转换为N2除去,氮元素的化合价降低,发生还原反应在电解池的阴极,故答案为:阴极;
(6)混合后c(AgNO3):$\frac{0.05×0.1}{5}$=1.0×10-3 mol•Lˉ1,而Qc=c(Ag+)c(NO2-)=1.0×10-3 mol•Lˉ1×1.0×10-6 mol•Lˉ1=1.0×10-9mol2•Lˉ2<2×10-8mol2•Lˉ2,所以不能生成沉淀,
答:不能,混合后c(AgNO3):$\frac{0.05×0.1}{5}$=1.0×10-3 mol•Lˉ1,而Qc=c(Ag+)c(NO2-)=1.0×10-3 mol•Lˉ1×1.0×10-6 mol•Lˉ1=1.0×10-9mol2•Lˉ2<2×10-8mol2•Lˉ2,所以不能生成沉淀.
点评 本题是一道综合知识的考查题,要求学生具有知识的梳理和迁移能力,难度大,综合性强,难度中等.

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
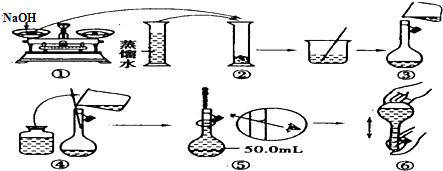
小博士期末闯关100分系列答案 取一定物质的量浓度的NaOH 溶液1 00mL,然后向其通入一定量的CO2气体,得到溶液A,向A 中逐滴缓慢加入0.1mol/L的HCl溶液,产生的CO2气体体积(标准状况)与所加HCl溶液的体积之间关系如图所示,下列有关说法不正确的是( )
取一定物质的量浓度的NaOH 溶液1 00mL,然后向其通入一定量的CO2气体,得到溶液A,向A 中逐滴缓慢加入0.1mol/L的HCl溶液,产生的CO2气体体积(标准状况)与所加HCl溶液的体积之间关系如图所示,下列有关说法不正确的是( )| A. | A溶液中溶质Na2CO3和NaHCO3物质的量比为l:l | |
| B. | A溶液中溶质NaOH和Na2CO3物质的量比为l:l | |
| C. | 原Na0H 溶液物质的量浓度为0.075mol/L | |
| D. | 通入CO2气体在标况下的体积为56mL |
| A. | 16.9 g BaO2固体中阴、阳离子总数为0.2NA | |
| B. | 标况下,5.6 L NO和5.6 L O2的混合气体中含有的分子数为0.375NA | |
| C. | 标准状况下,11.2 L乙烯含有的极性共价键数目为NA | |
| D. | 100 mL 0.1 mol•L-1的硫酸铝溶液中含有的Al3+为0.02NA个 |
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
(1)根据表中的所给数据分析,同主族内的不同元素X的值变化的规律是:自上而下电负性降低;
(2)预测周期表中电负性最大的元素应为F(写元素符号);估计钙元素的电负性的取值范围:0.8<X<1.2.
(3)简述元素电负性X的大小与元素金属性、非金属性之间的关系非金属性越强电负性越大,金属性越强电负性越小.
(4)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlBr3中形成的化学键的类型为共价键.

 X、Y、Z、U、W是原子序数依次增大的前四周期元素.其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2; U是第三周期元素形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子.请回答下列问题:
X、Y、Z、U、W是原子序数依次增大的前四周期元素.其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2; U是第三周期元素形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子.请回答下列问题:
 $\stackrel{H_{2}O/H+}{→}$
$\stackrel{H_{2}O/H+}{→}$
 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$ (-NH2易被氧化)
(-NH2易被氧化) .
. .
.
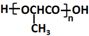 的合成路线:
的合成路线: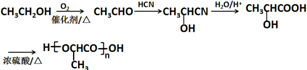 .(无机试剂任选)合成路线示例:CH≡CH$→_{催化剂/△}^{H_{2}}$CH2=CH2$→_{催化剂/△}^{HCl}$CH3CH2Cl.
.(无机试剂任选)合成路线示例:CH≡CH$→_{催化剂/△}^{H_{2}}$CH2=CH2$→_{催化剂/△}^{HCl}$CH3CH2Cl.