题目内容
17.NA代表阿伏加德罗常数的值,下列叙述正确的是( )| A. | 常温常压下,17g甲基(-14CH3)所含的中子数为9NA | |
| B. | 10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8% | |
| C. | 热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1300 kJ•mol-1,有 NA个水分子生成且为 液体时,吸收1300 kJ的能量 | |
| D. | 在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移2 NA个电子 |
分析 A、求出甲基(-14CH3)的物质的量,然后根据1mol甲基(-14CH3)中含8mol中子来分析;
B、稀释以后,硫酸溶液的密度变小,m(100ml硫酸)<10×m(10ml硫酸),而溶质硫酸的质量不变;
C、反应C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1300 kJ•mol-1放热;
D、H2O2+Cl2=2HCl+O2反应中,生成1mol氧气转移2mol电子.
解答 解:A、17g甲基(-14CH3)的物质的量为1mol,而1mol甲基(-14CH3)中含8mol中子,故含8NA个,故A错误;
B、由于稀释以后,硫酸溶液的密度变小,m(100ml硫酸)<10×m(10ml硫酸),而溶质硫酸的质量不变,故质量分数大于9.8%,故B错误;
C、反应C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1300 kJ•mol-1放热,不是吸热,故C错误;
D、H2O2+Cl2=2HCl+O2反应中,生成1mol氧气转移2mol电子,即当生成32g氧气时,转移2NA个电子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
8.下列有关金属的说法中,不正确的是( )
| A. | 青铜、不锈钢和硬铝都是合金 | |
| B. | 铝可用于制造燃烧弹和信号弹 | |
| C. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用,因此铝罐可久盛食醋 | |
| D. | 铜锈的主要成分是Cu2(OH)2CO3,可以用稀盐酸除铜锈 |
5. Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )
 Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )| A. | Mg电极是该电池的正极 | |
| B. | H2O2在石墨电极上发生氧化反应 | |
| C. | 石墨电极附近溶液的OH-的物质的量浓度增大 | |
| D. | 溶液中Cl-向正极移动 |
12.下列各组气体,经充分反应后,原来的气体有剩余的是( )
| A. | 1molNH3和 1molHCl混合 | |
| B. | 1mol NO和 0.5 molO2混合 | |
| C. | 1molSO2和 1 molH2S混合 | |
| D. | 等体积的NO和NO2被足量烧碱溶液吸收 |
2.1932年美国化学家鲍林首先提出了电负性的概念.电负性(用X表示)也是元素的一种重要性质,如表给出的是原子序数小于20的16种元素的电负性数值:
请仔细分析,回答下列有关问题:
(1)根据表中的所给数据分析,同主族内的不同元素X的值变化的规律是:自上而下电负性降低;
(2)预测周期表中电负性最大的元素应为F(写元素符号);估计钙元素的电负性的取值范围:0.8<X<1.2.
(3)简述元素电负性X的大小与元素金属性、非金属性之间的关系非金属性越强电负性越大,金属性越强电负性越小.
(4)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlBr3中形成的化学键的类型为共价键.
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
(1)根据表中的所给数据分析,同主族内的不同元素X的值变化的规律是:自上而下电负性降低;
(2)预测周期表中电负性最大的元素应为F(写元素符号);估计钙元素的电负性的取值范围:0.8<X<1.2.
(3)简述元素电负性X的大小与元素金属性、非金属性之间的关系非金属性越强电负性越大,金属性越强电负性越小.
(4)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlBr3中形成的化学键的类型为共价键.
9.常温下一种烷烃A和一种单烯烃B组成混合气体,A和B分子中最多只含有4个碳原子,且B分子的碳原子数比A分子的多.120℃时取1L该混合气体与9LO2混合充分燃烧后得2.5LCO2.当恢复到120℃和燃烧前的压强时,体积增大6.25%.则混合气体中各成分的分子式为( )
| A. | CH4和C4H8 | B. | CH4和C3H6 | C. | C2H6和C3H6 | D. | C2H6和C4H8 |
9.合成氨时能使合成氨反应进行程度增大的方法是( )
| A. | 升高温度 | B. | 降低压强 | C. | 使用催化剂 | D. | 及时分离出NH3 |

 $\stackrel{H_{2}O/H+}{→}$
$\stackrel{H_{2}O/H+}{→}$
 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$ (-NH2易被氧化)
(-NH2易被氧化) .
. .
.
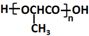 的合成路线:
的合成路线: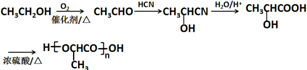 .(无机试剂任选)合成路线示例:CH≡CH$→_{催化剂/△}^{H_{2}}$CH2=CH2$→_{催化剂/△}^{HCl}$CH3CH2Cl.
.(无机试剂任选)合成路线示例:CH≡CH$→_{催化剂/△}^{H_{2}}$CH2=CH2$→_{催化剂/△}^{HCl}$CH3CH2Cl.
 .
.