题目内容
13.当氢氧化钙固体在水中达到溶解平衡时,为使Ca(OH)2固体的量减少,需加入少量的( )| A. | NH4NO3固体 | B. | NaOH固体 | C. | CaCl2固体 | D. | NaHSO4固体 |
分析 根据平衡移动原理及溶度积解答,要使Ca (OH)2 固体的量减少平衡向由移动,可以加水,或降低Ca2+或OH-的浓度.
解答 解:A、加入少量NH4NO3固体,NH4+与OH-结合生成氨水,故氢氧根的浓度减小,故平衡右移Ca(OH)2固体的量减少,故A正确;
B、加入NaOH,OH-的浓度增大,平衡向左移动,Ca (OH)2 固体的量增大,故B错误;
C、加入少量CaCl2固体,Ca2+的浓度增大,Ca (OH)2 固体的量增大,故C错误;
D、加入少量NaHSO4固体,OH-与氢离子反应,OH-的浓度降低,平衡向由移动,Ca (OH)2 固体的量减小,故D正确;
故选AD.
点评 本题考查化学平衡的移动,主要是沉淀溶解平衡的分析应用,注意加入试剂所提供的离子对平衡的影响,题目难度中等,

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.下列说法不正确的是( )
| A. | 高温结构陶瓷、光导纤维均属于新型无机非金属材料 | |
| B. | 糖类、油脂、蛋白质是人类重要的营养物质 | |
| C. | 煤、石油、天然气均属于可再生的化石燃料 | |
| D. | 塑料、合成纤维、合成橡胶是三大合成材料 |
4.下列各组物质,按化合物、单质、混合物顺序排列的是( )
| A. | CO2、Fe、HCl | B. | NaOH、液态O2、碘酒 | ||
| C. | 生石灰、白磷、熟石灰 | D. | 空气、氮气、硫酸铜 |
8.某有机物的结构简式如图所示,按官能团分类,它不属于( )


| A. | 烯烃类 | B. | 酚类 | C. | 醚类 | D. | 醇类 |
9.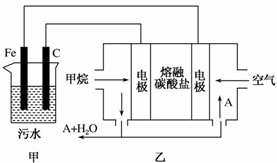 工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.某科研小组用该原理处理污水,设计的装置如图所示.下列说法正确的是( )
工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.某科研小组用该原理处理污水,设计的装置如图所示.下列说法正确的是( )
 工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.某科研小组用该原理处理污水,设计的装置如图所示.下列说法正确的是( )
工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.某科研小组用该原理处理污水,设计的装置如图所示.下列说法正确的是( )| A. | 为了增加污水的导电能力,应向污水中加入适量的H2SO4溶液 | |
| B. | 甲装置中Fe电极的反应为Fe-3e-═Fe3+ | |
| C. | 为了使燃料电池乙长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为CO2 | |
| D. | 当乙装置中有1.6 gCH4参加反应时,C电极理论上生成气体的体积在标况下为4.48 L |
6.化学与人类生产、生活密切相关,下列说法正确的是( )
| A. | 蚕丝和棉花的组成元素相同,结构不同,因而性质不同 | |
| B. | 汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的 | |
| C. | 古代的陶瓷、砖瓦、现代的玻璃、水泥等,都是硅酸盐产品 | |
| D. | 工业上通过电解熔融的氯化物制取Na、Mg、Al三种金属 |


 $\stackrel{H_{2}O/H+}{→}$
$\stackrel{H_{2}O/H+}{→}$
 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$ (-NH2易被氧化)
(-NH2易被氧化) .
. .
.
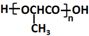 的合成路线:
的合成路线: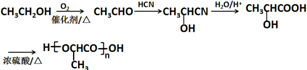 .(无机试剂任选)合成路线示例:CH≡CH$→_{催化剂/△}^{H_{2}}$CH2=CH2$→_{催化剂/△}^{HCl}$CH3CH2Cl.
.(无机试剂任选)合成路线示例:CH≡CH$→_{催化剂/△}^{H_{2}}$CH2=CH2$→_{催化剂/△}^{HCl}$CH3CH2Cl.