题目内容
12.Li-Al/FeS电池具有大容量、小污染、低成本及原料储备丰富等优点,电池总反应式为:4Li+FeS2$?_{充电}^{放电}$2Li2S+Fe,下列有关该电池的说法正确的是( )| A. | 放电时,锂铝合金作负极,Li+向负极移动 | |
| B. | 充电时,阴极的电极反应式为:Fe+2Li2S-4e-=4Li++FeS2 | |
| C. | 该电池可用LiCl水溶液作电解质溶液 | |
| D. | 以Al作阳极,FeS为阴极,LiCl-KCl低共熔混合物为电解质进行电解,可以制得FeS2 |
分析 A、原电池阳离子向正极移动;
B、充电时,阳极发生氧化反应;
C、金属锂可以和水之间发生反应;
D、FeS为阳极,Al为阴极,阳极上会发生失电子的氧化反应.
解答 解:A、原电池阳离子向正极移动,Li+向正极移动,故A错误;
B、充电时,阳极发生氧化反应,电极反应式为:Fe+2Li2S-4e-=4Li++FeS2,故正确;
C、金属锂可以和水之间发生反应,所以该电池可采用熔融LiCl为电解质,故C错误;
D、以Al作阳极,铝本身放电,所以FeS为阳极,Al为阴极,阳极上会发生失电子的氧化反应,发生的电极反应为:2FeS-2e-=FeS2+Fe2+,故D错误;
故选B.
点评 本题综合考查学生元素以及化合物的性质、电化学反应原理等基本知识,属于综合知识的考查,难度中等.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
2.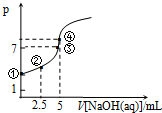 常温下向10mL 0.1mol•L-1HN3(叠氮酸)溶液中逐滴滴加0.2mol•L-1的NaOH溶液,溶液pH的变化曲线如图所示(溶液混合时体积的变化、温度忽略不计,HN3的Ka=10-4.7).下列说法不正确的是( )
常温下向10mL 0.1mol•L-1HN3(叠氮酸)溶液中逐滴滴加0.2mol•L-1的NaOH溶液,溶液pH的变化曲线如图所示(溶液混合时体积的变化、温度忽略不计,HN3的Ka=10-4.7).下列说法不正确的是( )
 常温下向10mL 0.1mol•L-1HN3(叠氮酸)溶液中逐滴滴加0.2mol•L-1的NaOH溶液,溶液pH的变化曲线如图所示(溶液混合时体积的变化、温度忽略不计,HN3的Ka=10-4.7).下列说法不正确的是( )
常温下向10mL 0.1mol•L-1HN3(叠氮酸)溶液中逐滴滴加0.2mol•L-1的NaOH溶液,溶液pH的变化曲线如图所示(溶液混合时体积的变化、温度忽略不计,HN3的Ka=10-4.7).下列说法不正确的是( )| A. | 水电离出的c(OH-):①点小于 ③点 | |
| B. | 此反应的滴定实验宜选用甲基橙做指示剂 | |
| C. | ②点时c(N3-)>c(Na+)>c(HN3)>c(H+)>c(OH-) | |
| D. | ④点时c(Na+)=c(N3-)+c(HN3)=$\frac{1}{15}$mol•L-1 |
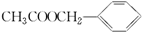 )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下: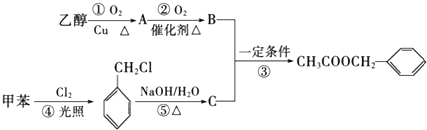
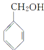 ,B中含氧官能团的名称是羧基.
,B中含氧官能团的名称是羧基.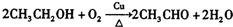 ;
; .
. 某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题:
某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题: 乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO${\;}_{4}^{-}$+5H2C2O4+6H+═=2Mn2++10CO2↑+8H2O学习小组的同学设计了滴定的方法测定x值.
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO${\;}_{4}^{-}$+5H2C2O4+6H+═=2Mn2++10CO2↑+8H2O学习小组的同学设计了滴定的方法测定x值.
