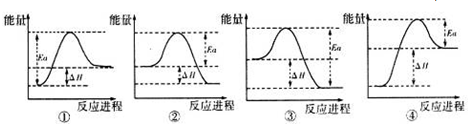
题目内容
3.某二元化合物甲有刺鼻气味,极易被水和酸吸收,是一类重要的火箭燃料.将3.20g甲加热至完全分解,得到一种常见的气体单质和4.48L的H2(已折算成标准状况);已知甲分子内各原子均达到稳定结构.工业上用尿素[CO(NH2)2]投料到按一定比例混合的NaClO与NaOH混合溶液中反应可制得甲,同时得到副产品碳酸钠等物质.(1)写出甲的分子式N2H4.
(2)适量氯气通入NaOH溶液中可以得到上述混合溶液,写出该反应的离子反应方程式:Cl2+2OH-=ClO-+Cl-+H2O.
(3)工业上常用甲使锅炉内壁的铁锈转化为结构较致密的磁性氧化铁(Fe3O4),以减慢锅炉内壁的锈蚀.其化学方程式为N2H4+6Fe2O3=N2↑+4Fe3O4+2H2O.
(4)已知:Cu2O+2H+═Cu+Cu2++H2O.
①甲与新制Cu(OH)2之间能发生反应,从氧化还原反应的角度说明其合理性N2H4中N元素为-2价,处于较低价态具有还原性,而Cu(OH)2中Cu元素为+2价,处于最高价态,具有氧化性;.
②甲与新制Cu(OH)2充分反应,有红色固体乙生成,写出乙的成分Cu或Cu、Cu2O或Cu2O(写出所有可能),请设计实验方案检验乙的成分取红色固体乙ag,加入足量稀硫酸充分反应后,过滤、洗涤、干燥、称量的bg沉淀,通过a、b的数量关系判断即可,若a=b,固体乙的成分是Cu;若$\frac{64a}{144}$=b,固体乙的成分是Cu2O,若$\frac{64a}{144}$<b<a,固体乙的成分是Cu和Cu2O.
分析 甲加热至完全分解,得到一种常见的气体单质和4.48L的H2(已折算成标准状况),则甲中含有H元素,工业上用尿素[CO(NH2)2]投料到按一定比例混合的NaClO与NaOH混合溶液中反应可制得甲,同时得到副产品碳酸钠等物质,根据元素守恒可知甲中含有N元素,综上可知,甲中含有N和H两种元素,n(H2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,则m(H)=0.2mol×2×1g/mol=0.4g,则3.20g甲中含有m(N)=3.20g-0.4g=2.8g,n(N)=$\frac{2.8g}{14g/mol}$=0.2mol,所以n(N):n(H)=0.2mol:0.4mol=1:2,甲分子内各原子均达到稳定结构,可知甲为N2H4.
解答 解:甲加热至完全分解,得到一种常见的气体单质和4.48L的H2(已折算成标准状况),则甲中含有H元素,工业上用尿素[CO(NH2)2]投料到按一定比例混合的NaClO与NaOH混合溶液中反应可制得甲,同时得到副产品碳酸钠等物质,根据元素守恒可知甲中含有N元素,综上可知,甲中含有N和H两种元素,n(H2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,则m(H)=0.2mol×2×1g/mol=0.4g,则3.20g甲中含有m(N)=3.20g-0.4g=2.8g,n(N)=$\frac{2.8g}{14g/mol}$=0.2mol,所以n(N):n(H)=0.2mol:0.4mol=1:2,甲分子内各原子均达到稳定结构,可知甲为N2H4.
(1)甲的分子式为:N2H4,故答案为:N2H4;
(2)适量氯气通入NaOH溶液中可以得到上述混合溶液,该反应的离子反应方程式:Cl2+2OH-=ClO-+Cl-+H2O,
故答案为:Cl2+2OH-=ClO-+Cl-+H2O;
(3)工业上常用甲使锅炉内壁的铁锈转化为结构较致密的磁性氧化铁(Fe3O4),以减慢锅炉内壁的锈蚀,Fe元素化合价降低,则N元素被氧化生成氮气,其化学方程式为:N2H4+6Fe2O3=N2↑+4Fe3O4+2H2O,
故答案为:N2H4+6Fe2O3=N2↑+4Fe3O4+2H2O;
(4)已知:Cu2O+2H+═Cu+Cu2++H2O.
①N2H4中N元素为-2价,处于较低价态具有还原性,而Cu(OH)2中Cu元素为+2价,处于最高价态,具有氧化性,甲与新制Cu(OH)2之间能发生反应,
故答案为:N2H4中N元素为-2价,处于较低价态具有还原性,而Cu(OH)2中Cu元素为+2价,处于最高价态,具有氧化性;
②甲与新制Cu(OH)2充分反应,有红色固体乙生成,乙的成分可能为:Cu或Cu、Cu2O或Cu2O,
取红色固体乙ag,加入足量稀硫酸充分反应后,过滤、洗涤、干燥、称量的bg沉淀,通过a、b的数量关系判断即可,若a=b,固体乙的成分是Cu;若$\frac{64a}{144}$=b,固体乙的成分是Cu2O,若$\frac{64a}{144}$<b<a,固体乙的成分是Cu和Cu2O,
故答案为:Cu或Cu、Cu2O或Cu2O;取红色固体乙ag,加入足量稀硫酸充分反应后,过滤、洗涤、干燥、称量的bg沉淀,通过a、b的数量关系判断即可,若a=b,固体乙的成分是Cu;若$\frac{64a}{144}$=b,固体乙的成分是Cu2O,若$\frac{64a}{144}$<b<a,固体乙的成分是Cu和Cu2O.
点评 本题考查无机物的推断、氧化还原反应、实验方案设计,属于计算型推断,侧重考查学生分析计算能力、知识的迁移应用,题目难度中等.

 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案| A. | 用相互滴加的方法鉴别Ca(OH)2和NaHCO3溶液 | |
| B. | 向CH3CH2Br中滴入AgNO3溶液以检验溴元素 | |
| C. | 用溴的四氯化碳溶液吸收SO2气体 | |
| D. | 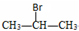 与NaOH的醇溶液共热制备CH3-CH=CH2 与NaOH的醇溶液共热制备CH3-CH=CH2 |
| X | |||
| Y | Z | W | |
| T |
| A. | 化合物YX2、ZX2化学键类型和晶体类型均相同 | |
| B. | Z、W、T三种元素最高价氧化物的水化物的酸性依次增强 | |
| C. | 五种元素中,只有T是金属元素 | |
| D. | Mg在一定条件下可以和YX2发生反应生成Y单质 |
| A. | 苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键 | |
| B. | 己烷和苯可以用酸性高锰酸钾溶液鉴别 | |
| C. | 甲烷和氯气反应生成一氯甲烷,苯和氢气反应生成环己烷,二者反应类型相同 | |
| D. | 在水溶液里,乙酸分子中的-CH3可以电离出H+ |

下列推断正确的是( )
| A. | ②、③互为同系物 | |
| B. | ①、③各1mol与足量氢氧化钠溶液反应时均消耗3molNaOH | |
| C. | 等物质的量的②、④分别在足量氧气中完全燃烧,前者消耗氧气比后者少 | |
| D. | ③、④互为同分异构体,它们各1mol均能与5molH2加成 |
| A. | 放电时,锂铝合金作负极,Li+向负极移动 | |
| B. | 充电时,阴极的电极反应式为:Fe+2Li2S-4e-=4Li++FeS2 | |
| C. | 该电池可用LiCl水溶液作电解质溶液 | |
| D. | 以Al作阳极,FeS为阴极,LiCl-KCl低共熔混合物为电解质进行电解,可以制得FeS2 |
完成下列填空:
(1)上述反应涉及的第三周期元素中,离子半径最小的是Al3+;Cl原子与Si原子可构成有5个原子核的分子,其分子的空间构型为正四面体.
(2)用最详尽描述核外电子运动状态的方式,表示氧离子核外电子的运动状态
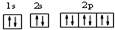 .
.(3)Na和O2反应形成Na2O和Na2O2的混合物,阴阳离子的个数比为1:2;NaAlSi3O8改写成氧化物形式是Na2O•Al2O3•6SiO2.
(4)某兴趣小组为研究上述反应中钾元素的熔出率(液体中钾元素的质量占样品质量分数)与温度的关系,进行实验(保持其它条件不变),获得如下数据:
时间/h 熔出率 温度 | 1.5 | 2.5 | 3.0 | 3.5 | 4.0 |
| 800℃ | 0.054 | 0.091 | 0.127 | 0.149 | 0.165 |
| 830℃ | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 |
| 860℃ | 0.515 | 0.624 | 0.671 | 0.690 | 0.689 |
| 950℃ | 0.669 | 0.711 | 0.713 | 0.714 | 0.714 |
(5)Na(l)+KCl(l)?NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,该方法可行的原因是根据勒夏特列原理,将钾蒸气分离出来(降低了产物的浓度),化学平衡向正反应方向移动.
(6)铝可用于冶炼难熔金属,利用铝的亲氧性,还可用于制取耐高温的金属陶瓷.例如将铝粉、石墨和二氧化钛按一定比例混合均匀,涂在金属表面上,然后在高温下煅烧,可在金属表面形成耐高温的涂层TiC,该反应的化学方程式为4Al+3TiO2+3C $\frac{\underline{\;高温\;}}{\;}$2Al2O3+3TiC.

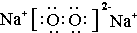
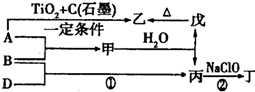
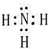 ,丁中所包含的化学键类型有bc(填字母序号).
,丁中所包含的化学键类型有bc(填字母序号).