题目内容
4. 某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题:
某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题:(1)用酚酞作指示剂,滴定到达终点时,溶液由无色变为浅红色.
(2)滴定时,眼睛注视锥形瓶中溶液的颜色变化.
(3)下列操作能使测出的盐酸浓度偏低的是①④填序号:
①碱式滴定管用蒸馏水洗净后,未经标准液润洗就注入标准NaOH溶液
②滴定前,读碱式滴定管液体体积时仰视液面,滴定后读碱液体积时,俯视液面
③锥形瓶未用待测液润洗
④滴定过程中振荡时有液滴溅出
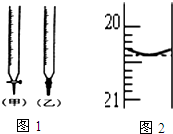
(4)滴定管如图1所示,用乙滴定管盛装标准浓度的氢氧化钠溶液(填“甲”或“乙”).
(5)若实验取待测液体积为20.00mL,碱式滴定管初读数为0.00mL,达到终点时读数如图2,则待测液物质的量浓度为1.02mol/L.
分析 (1)根据反应结束前溶液为无色,反应结束时溶液为浅红色判断滴定终点;
(2)中和滴定操作中,眼睛应该注视着锥形瓶中溶液的颜色变化;
(3)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
(4)由图可知甲为酸式滴定管,乙为碱式滴定管,氢氧化钠溶液应用碱式滴定管;
(5)根据滴定管的结构和精确度为0.01mL读出读数从而求出NaOH溶液的体积,根据HCl~NaOH求盐酸的物质的量浓度.
解答 解:(1)0.1000mol/LNaOH溶液滴定待测盐酸溶液,反应结束前溶液为无色,滴定结束时溶液为浅红色,则滴定终点的现象为:溶液由无色变为浅红色,且半分钟内不褪色,
故答案为:浅红;
(2)酸碱中和滴定实验中,滴定时眼睛注视锥形瓶中溶液的颜色变化,以便及时判断滴定终点;
故答案为:锥形瓶中溶液的颜色变化;
(3)①碱式滴定管用蒸馏水洗净后,未经标准液润洗就注入标准NaOH溶液,标准NaOH溶液被稀释,导致V(标准)偏大,据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,c(待测)偏大,故①错误;
②滴定前,读碱式滴定管液体体积时仰视液面,滴定后读碱液体积时,俯视液面,导致V(标准)偏小,据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,c(待测)偏小,故②正确;
③锥形瓶未用待测液润洗,待测液的物质的量不变,V(标准)不变,据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,c(待测)不变,故③错误;
④滴定过程中振荡时有液滴溅出,待测液的物质的量偏小,V(标准)偏小,据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,c(待测)偏小,故④正确;
故选①④;
(4)由图可知甲为酸式滴定管,乙为碱式滴定管,NaOH溶液应用碱式滴定管,即选择乙注入NaOH溶液;
故答案为:乙;
(5)若实验取待测液体积为20.00mL,碱式滴定管初读数为0.00mL,终点时读数为20.40mL,则消耗NaOH溶液的体积为20.40mL,设盐酸溶液浓度为
C(HCl)
HCl~NaOH
1 1
C(HCl)×20.00mL 0.1000mol/L×20.40mL
解得:C(NaOH)=1.02mol/L
故答案为:1.02mol/L.
点评 本题主要考查了中和滴定操作、误差分析,难度不大,理解中和滴定的原理是解题关键,注意滴定管的读数为易错点.

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案| A. | 过氧化钠与水反应生成2.24 L O2时转移的电子数为0.2NA | |
| B. | 1 L 14 mol/L硝酸与足量铜反应生成气体分子数小于7NA | |
| C. | 1 L1 mol/L NaHS溶液中H2S、HS-和S2-粒子数之和为NA | |
| D. | 1 mol OH-的电子总数比1 mol-OH的电子总数多NA |
| A. | 苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键 | |
| B. | 己烷和苯可以用酸性高锰酸钾溶液鉴别 | |
| C. | 甲烷和氯气反应生成一氯甲烷,苯和氢气反应生成环己烷,二者反应类型相同 | |
| D. | 在水溶液里,乙酸分子中的-CH3可以电离出H+ |
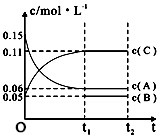
| A. | 若a=3,则b=1,c=2 | |
| B. | t1min时,该反应达到该条件下的反应限度 | |
| C. | 在O~t1min内,用C表示的化学反应速率为0.06mol•L-1 | |
| D. | B的起始浓度等于0.08mol•L-1 |
| A. | 放电时,锂铝合金作负极,Li+向负极移动 | |
| B. | 充电时,阴极的电极反应式为:Fe+2Li2S-4e-=4Li++FeS2 | |
| C. | 该电池可用LiCl水溶液作电解质溶液 | |
| D. | 以Al作阳极,FeS为阴极,LiCl-KCl低共熔混合物为电解质进行电解,可以制得FeS2 |
 使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).Ⅰ.实验步骤:
(1)配制100mL待测白醋溶液.量取10.00mL食用白醋,注入烧杯中用水稀释后转移到100mL容量瓶(填仪器名称)中定容,摇匀即得.
(2)取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
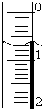
(3)读取盛装0.1000mol/L NaOH 溶液的碱式滴定管(填仪器名称)的初始读数.如果液面位置如右图所示,则此时的读数为0.70mL.
(4)滴定.当溶液由无色恰好变为红色,并在半分钟内不褪色时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
Ⅱ.实验记录
| 滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
(1)经计算,市售白醋总酸量=4.5g/100mL
(2)在本实验滴定过程中,下列操作会使实验结果偏大是ab(填写序号)
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管尖嘴在滴定前无气泡,滴定后有气泡
c.锥形瓶中加入待测溶液后,再加少水
d.锥形瓶在滴定时剧烈摇动,有少液体溅出.
| A. | Fe2++2NH3•H2O═Fe(OH)2↓+2NH4+ | |
| B. | Fe2++NH3•H2O+HCO3-═FeCO3↓+NH4++H20 | |
| C. | Fe2++2HCO3-═Fe(OH)2↓+2CO2↑ | |
| D. | 2Fe2++HCO3-+3NH3•H2O═Fe2(OH)2CO3↓+3NH4++H2O |
 的烃X,红外光谱和核磁共振表明其分子中氢原子的化学环境只有一种,根据分析,下列说法中不正确的是( )
的烃X,红外光谱和核磁共振表明其分子中氢原子的化学环境只有一种,根据分析,下列说法中不正确的是( )| A. | X的分子式为C5H4 | |
| B. | X中碳原子的化学环境有2种 | |
| C. | 1 mol X在一定条件下可与2 mol氢气发生反应 | |
| D. | X不能使酸性高锰酸钾溶液褪色 |
 如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后溶液中有黑色现象出现.过一段时间后,经硫酸酸化的高锰酸钾溶液褪色.经分析得知:产生的气体中含有CH2=CH2、SO2、CO2、H2O.
如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后溶液中有黑色现象出现.过一段时间后,经硫酸酸化的高锰酸钾溶液褪色.经分析得知:产生的气体中含有CH2=CH2、SO2、CO2、H2O.