题目内容
11.一定条件下,将NO2 与SO22以体积比1:2 置于密闭容器中发生反应:NO2(g)+SO2(g)?SO2(g)+NO(g)下列能说明该反应达到平衡状态的是( )| A. | v(SO3 )=v(NO2) | |
| B. | 混合气体的密度保持不变 | |
| C. | 混合气体的颜色保持不变 | |
| D. | 每消耗1 mol SO3的同时生成1 mol NO2 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、v(SO3 )=v(NO2),未体现正、逆反应的关系,故A错误;
B、混合气体的密度一直保持不变,故B错误;
C、混合气体的颜色保持不变,说明二氧化氮的浓度保持不变,正逆反应速率相等,故C正确;
D、每消耗1 mol SO3的同时生成1 mol NO2,都体现逆反应的方向,故D错误;
故选C.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
相关题目
2.现有部分元素的性质与原子(或分子)结构如表:
(1)X形成的双原子分子的结构式为O=O,X形成的氢化物的沸点在同族元素形成的氢化物中是最高(填“最高”或“最低”),原因是水分子间存在氢键.
(2)金属冶炼Y单质的化学方程式为2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑.
(3)Y单质与W元素的最高价氧化物对应水化物恰好反应完全,向反应后的溶液中通入过量的CO2,发生反应的离子方程式为AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-.
(4)单质Cu在一定条件下与足量Z元素形成的强酸浓溶液反应生成的气体是SO2(填化学式),检验该气体的常用试剂品红溶液.
| 元素编号 | 元素性质与原子(或分子)结构 |
| X | 地壳中含量最高的非金属元素 |
| Y | M层比K层多1个电子 |
| Z | 最外层电子数为内层电子数的0.6倍 |
| W | 与氯形成的氯化物是生活中常用的调味品 |
(2)金属冶炼Y单质的化学方程式为2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑.
(3)Y单质与W元素的最高价氧化物对应水化物恰好反应完全,向反应后的溶液中通入过量的CO2,发生反应的离子方程式为AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-.
(4)单质Cu在一定条件下与足量Z元素形成的强酸浓溶液反应生成的气体是SO2(填化学式),检验该气体的常用试剂品红溶液.
19.下列冇关实验方法或操作正确的( )
| A. |  喷泉实验 | B. |  氯气除杂 氯气除杂 | C. |  分离汽油和水 | D. |  丁达尔效应 |
3.高温条件下,Al和Fe2O3反应生成Fe和Al2O3.下列说法正确的是( )
| A. |  该反应过程中的能量变化如图所示 | |
| B. | 该反应条件下,Al的还原性强于Fe | |
| C. | 反应中每生成1 mol Fe转移6×6.02×1023个电子 | |
| D. | 实验室进行该反应时常加入KClO3作催化剂 |
20.化学与生产、生活密切相关.下列叙述正确的是( )
| A. | 煤的干馏和煤的液化均是物理变化 | |
| B. | 天然纤维和合成纤维的主要成分都是纤维素 | |
| C. | 海水淡化的方法有蒸馏法、电渗析法等 | |
| D. | 用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同 |
1.下列实验的现象和所得结论均正确的是( )
| 选项 | 实验 | 现象 | 由现象所得结论 |
| A | 将Cl2通入品红溶液 | 品红褪色 | Cl2具有漂白性 |
| B | 向白色AgCl悬浊液中滴加0.1mol/LKI溶液 | 试管中白色沉淀转化为黄色沉淀. | Ksp(AgCl)>Ksp(AgI) |
| C | 将CO2通入CaCl2溶液中 | 无明显现象 | 非金属性:Cl>C |
| D | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝滴落下来 | 金属铝的熔点较低 |
| A. | A | B. | B | C. | C | D. | D |
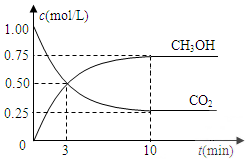 已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积固定为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积固定为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.



 如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空: