题目内容
16. 如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:①电源A上的a为正极
②欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为:Zn-2e-=Zn2+,电极f上发生的反应为Zn2++2e-=Zn,槽中盛放的镀液可以是ZnSO4溶液.
分析 ①由B上的c点显红色判断c的电极,根据c的电极判断a、b的电极;
②先判断e、f的电极,再根据阴阳极上发生的反应写出相应的电极反应式;根据电镀原理选取电解质.
解答 解:①B外接电源,所以是电解氯化钠溶液的电解池,接通电路后,发现B上的c点显红色,说明c点有氢氧根离子生成,根据离子的放电顺序知,该极上氢离子得电子放电,所以c是阴极,外电源b是负极,a是正极,
故答案为:正;
②电镀时,e是阳极,f是阴极,镀层锌作阳极,镀件铁作阴极,阳极上锌失电子变成离子进入溶液,电极反应式为Zn-2e-=Zn2+,阴极上锌离子得电子生成锌单质,阴极上的电极反应式为Zn2++2e-=Zn;电镀液的选取:用含有镀层金属离子的溶液作电镀液,所以可选ZnSO4溶液作电镀液.
故答案为:Zn-2e-=Zn2+,Zn2++2e-=Zn,ZnSO4.
点评 本题考查了电解原理与电镀池,判断电极是关键,离子掌握溶液中离子的放电顺序及电极反应方程式书写,难度中等.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案
相关题目
12.下列有关说法正确的是( )
| A. | 在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解 | |
| B. | 将AlCl3溶液滴加到浓氢氧化钠溶液中,立即产生大量白色沉淀 | |
| C. | 向FeSO4溶液中先滴入KSCN溶液再滴加H2O2溶液,若变为血红色,Fe2+既有氧化性又有还原性 | |
| D. | 铁粉作食品袋内的脱氧剂 |
7.在一定温度和压强下,把装有NO和NO2的混合气体的试管倒立于水中,充分反应后,试管内气体的体积缩小为原气体体积的$\frac{1}{2}$,则原混合气体中NO和NO2的体积比为( )
| A. | 3:l | B. | 1:3 | C. | 2:3 | D. | 3:2 |
11.一定条件下,将NO2 与SO22以体积比1:2 置于密闭容器中发生反应:NO2(g)+SO2(g)?SO2(g)+NO(g)下列能说明该反应达到平衡状态的是( )
| A. | v(SO3 )=v(NO2) | |
| B. | 混合气体的密度保持不变 | |
| C. | 混合气体的颜色保持不变 | |
| D. | 每消耗1 mol SO3的同时生成1 mol NO2 |
1.2016年12月,中共中央、国务院印发了《关于全面推行河长制的意见》,进一步加强水污染治理工作.下列做法不应该提倡的是( )
| A. | 用碱性废水中和处理酸性废水 | |
| B. | 将工业废液排入海洋以减少河道污染 | |
| C. | 生活污水无害化处理后用于绿化灌溉 | |
| D. | 推广使用高效、低毒农药,减轻水体污染 |
8.常温下,取铝土矿(含有Al2O3、FeO、Fe2O3、SiO2等物质)用硫酸浸出后的溶液,分别向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
| A. | 加入过量NaOH溶液:Na+、AlO2-、OH-、SO42- | |
| B. | 加入过量氨水:NH4+、Al3+、OH-、SO42- | |
| C. | 通入过量SO2:Fe2+、H+、SO32-、SO42- | |
| D. | 加入过量NaClO溶液:Fe2+、Na+、ClO-、SO42- |
5.从海带中提取碘应该包括灼烧、溶解、过滤、氧化、萃取、蒸馏等过程.下列有关图示操作正确的是( )
| A. |  用装置甲将海带灼烧成灰 | B. |  用装置乙过滤得含I-的溶液 | ||
| C. |  用装置丙分离出碘的CCl4溶液 | D. |  用装置丁蒸馏获得碘并回收CCl4 |
6.某无色溶液中加入铝片后有氢气产生,则下列离子在该溶液中肯定能大量共存的是( )
| A. | Na+ | B. | Mg2+ | C. | CO32- | D. | MnO4- |
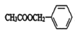 )存在于可可、咖啡、草莓等食品中,常用作食品香精.请回答下列问题:
)存在于可可、咖啡、草莓等食品中,常用作食品香精.请回答下列问题: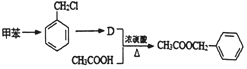
 的反应条件为光照
的反应条件为光照 生成D的反应化学方程式为
生成D的反应化学方程式为