题目内容
7.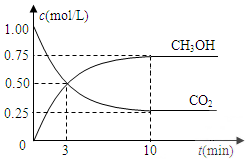 已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积固定为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积固定为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.(1)反应开始至第3分钟内,CO2的反应速率v(CO2)=$\frac{1}{6}$mol/(L•min).
(2)该条件下,反应的平衡常数K=$\frac{16}{3}$;
(3)能使容器内n(CH3OH):n(CO2)增大的措施有c.
a.升高容器内温度 b.加入适当的催化剂
c.将H2O(g)从容器中分离出去 d.向容器内充入氦气增压
(4)当反应进行到10分钟时,若向该密闭容器中再充入1mol CO2和3mol H2,维持其它反应条件不变,则对体系影响的下列观点,正确的是b.
a.反应的K值增大 b.CO2的转化率增大
c.达平衡后c(CH3OH)是10分钟时的2倍d.反应继续放出热能49kJ.
分析 (1)根据v=$\frac{△c}{△t}$计算;
(2)根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积计算;
(3)使n(CH3OH)/n(CO2)应采取措施,使平衡向正反应移动,注意不能增大二氧化碳或降低甲醇的量;
(4)a.平衡常数K是温度的函数;
b.若向该密闭容器中再充入1mol CO2和3mol H2,相当于增大压强,平衡正向移动,CO2的转化率增大;
c.若向该密闭容器中再充入1mol CO2和3mol H2,相当于增大压强,平衡正向移动,所以达平衡后c(CH3OH)比10分钟时的2倍大;
d.不可能完全反应.
解答 解:(1)反应开始至第3分钟内,氢气的平均反应速率v(CO2)=$\frac{0.5mol/L}{3min}$=$\frac{1}{6}$mol•L-1•min-1,故答案为:$\frac{1}{6}$;
(2)利用三段式解题法计算
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
K=$\frac{0.75×0.75}{0.25×0.7{5}^{3}}$=$\frac{16}{3}$,故答案为:$\frac{16}{3}$;
(3)使n(CH3OH)/n(CO2)应采取措施,使平衡向正反应移动,注意不能增大二氧化碳或降低甲醇的量,
a、该反应正反应是放热反应,升高温度平衡向逆反应移动,n(CH3OH)/n(CO2)减小,故a错误,
b、加入适当的催化剂,平衡不移动,故b错误;
c、将H2O(g)从体系中分离,平衡向正反应移动,n(CH3OH)/n(CO2)增大,故c正确;
d、充入He(g),使体系压强增大,容器的容积不变,反应混合物的浓度不变,平衡不移动,n(CH3OH)/n(CO2)不变,故d错误;
故答案为:c;
(4)a.平衡常数K是温度的函数,温度不变平衡常数不变,故错误;
b.若向该密闭容器中再充入1mol CO2和3mol H2,相当于增大压强,平衡正向移动,CO2的转化率增大,故正确;
c.若向该密闭容器中再充入1mol CO2和3mol H2,相当于增大压强,平衡正向移动,所以达平衡后c(CH3OH)比10分钟时的2倍大,故错误;
d.不可能完全反应,所以不可能反应继续放出热能49kJ,故错误;故选b.
点评 本题考查反应速率计算、化学平衡的计算与影响因素、平衡常数等,难度中等,注意基础知识的掌握,注意平衡移动应用.

 名题金卷系列答案
名题金卷系列答案| A. | 逸出SO3气体 | B. | 逸出SO2气体 | ||
| C. | 析出BaO3沉淀 | D. | 析出BaSO4沉淀和BaSO3沉淀 |
| A. | 钙和磷都是人体内含量丰富的矿物元素,它们都属于微量元素 | |
| B. | 垃圾焚烧和发电技术的结合,既解决了污染问题,又有效利用了垃圾所含的能量 | |
| C. | 制造普通玻璃的主要反应原理之一为:CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$=CaSiO3 | |
| D. | 青霉素是最早发现的天然抗生素,其中起治疗作用的是水杨酸 |
| 性质 | 应用 | |
| A | 铁比铜金属性强 | 可用FeCl3溶液腐蚀Cu制印刷电路板 |
| B | 活性炭具有吸附性 | 可用活性炭去除冰箱中的异味 |
| C | 油污在一定条件下会发生水解反应 | 可用热的纯碱溶液清除炊具上的油污 |
| D | 氢氟酸能与二氧化硅反应 | 可用氢氟酸在玻璃器皿上刻蚀标记 |
| A. | A | B. | B | C. | C | D. | D |
下列有关说法不正确的是( )
| A. | 高铁酸钾中铁显+6价 | |
| B. | Fe3+的氧化性强于FeO42- | |
| C. | 上述反应中氧化剂和还原剂的物质的量之比为3:2 | |
| D. | 用K2FeO4处理废水时其转化为Fe3+,因此K2FeO4具有杀菌和吸附双重作用 |
| A. | 在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解 | |
| B. | 将AlCl3溶液滴加到浓氢氧化钠溶液中,立即产生大量白色沉淀 | |
| C. | 向FeSO4溶液中先滴入KSCN溶液再滴加H2O2溶液,若变为血红色,Fe2+既有氧化性又有还原性 | |
| D. | 铁粉作食品袋内的脱氧剂 |
| A. | CO2通过Na2O2使其增重28 g 时,反应中转移的电子数为0.5NA | |
| B. | 25℃时,Ksp(BaSO4)=1×10-10,则 Ba SO4饱和溶液中Ba2+数目为=1×10-5 NA | |
| C. | 标准状况下,22.4 L CH2Cl2中共价键的数目为4NA | |
| D. | 高温下,16.8g Fe与足量的水蒸气完全反应失去电子的数目为0.8NA |
| A. | 增加A 的量,平衡不移动 | |
| B. | 增加B 的量,平衡正向移动 | |
| C. | 升高体系温度,平衡常数K 增大 | |
| D. | 压缩气体体积,正、逆反应速率均增大,平衡不移动 |
| A. | v(SO3 )=v(NO2) | |
| B. | 混合气体的密度保持不变 | |
| C. | 混合气体的颜色保持不变 | |
| D. | 每消耗1 mol SO3的同时生成1 mol NO2 |